Résumé
L’État de Californie exige l’analyse des pesticides, des mycotoxines et des cannabinoïdes dans tous les types de produits dérivés du cannabis [1]. Pour cette raison, il est nécessaire de développer des méthodes fiables pour la quantification de ces analytes dans diverses matrices. Les bonbons gélifiés au cannabis sont un aliment très populaire, mais leur composition en fait des matrices très complexes. Dans cet article, nous décrivons une méthode d’analyse de pesticides, mycotoxines et cannabinoïdes dans les bonbons gélifiés au cannabis, avec une simple et unique procédure d’extraction.
Introduction
Les produits comestibles infusés de cannabis ou de cannabidiol (CBD) gagnent en popularité auprès des consommateurs de cannabis. En termes de tests, l’analyse de la puissance de ces produits est obligatoire dans tous les états où les tests en laboratoire sont requis. De plus, dans l’État de Californie, la détermination des contaminants, comme les pesticides et les mycotoxines, dans les produits comestibles et autres produits dérivés du cannabis, est également une exigence. De par la grande variété de produits comestibles disponibles sur le marché, différents stratégies analytiques doivent être suivies afin d’obtenir des données analytiques fiables pour tous les analytes d’intérêt dans toutes les matrices. Parmi les différents types de produits comestibles au cannabis, les bonbons gélifiés offrent des défis uniques aux laboratoires d’analyse.
Les bonbons gélifiés sont des matrices “collantes”, généralement composés d’ingrédients tels que le sucre, l’amidon, la pectine et la gélatine. En raison de leur composition, les stratégies de préparation d’échantillons pour les analyses de puissance comprennent généralement une étape de solubilisation des échantillons dans des solvants comme l’eau ou le DMSO, mais de larges volumes de solvant comme le méthanol peuvent également être utilisés. Après homogénéisation des échantillons, les cannabinoïdes sont quantifiés par HPLC-UV, par injection soit des échantillons extraits dilués, soit des échantillons après traitement par des sels QuEChERS. Les informations accessibles au public sont rares et limitées en ce qui concerne l’analyse de contaminants tels que les pesticides ou les mycotoxines dans les matrices telles que les bonbons gélifiés, avec un seul rapport montrant des données semi-quantitatives pour 35 pesticides en utilisant la technique QuEChERS [2].
Dans cet article, nous proposons une méthode robuste pour la quantification de la liste californienne de pesticides, mycotoxines et cannabinoïdes, dans des échantillons de bonbons gélifiés. La méthodologie de préparation des échantillons a été optimisée, et implique une étape de solubilisation, suivie d’une étape d’extraction à l’acétonitrile acidifié puis d’une étape de dessalage à l’aide de sels QuEChERS EN. Pour l’analyse des cannabinoïdes et autres contaminants analysables par LC, une simple dilution a été effectuée avant l’injection. Pour les pesticides analysables par GC, l’utilisation d’un support dSPE composé d’amine primaire/secondaire (PSA), de noir de carbone graphite (GCB) et de sulfate de magnésium a été nécessaire avant l’analyse. Dans son ensemble, la méthode proposée pour l’analyse de pesticides, mycotoxines et cannabinoïdes dans les bonbons gélifiés au cannabis fournit des résultats satisfaisants en termes de linéarité, d’exactitude, de précision et de limites de quantification (LOQ).
Méthode
Préparation d’échantillons
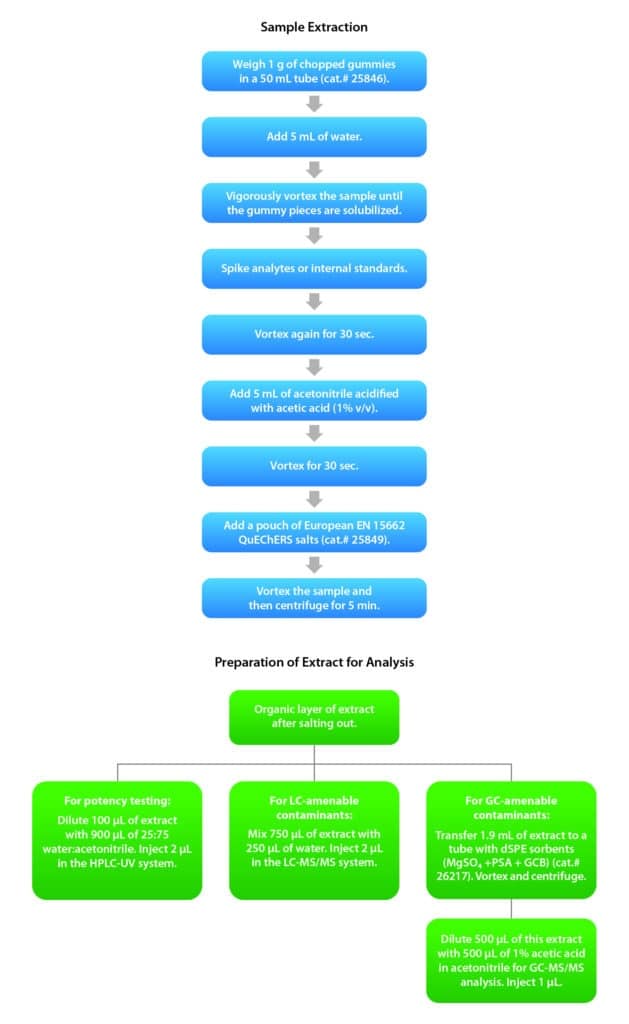
Après de nombreux tests préliminaires de différents paramètres expérimentaux, la méthode suivante a été mise en œuvre (Figure 1). Les bonbons gélifiés ont été hachés puis pesés (1 g) dans un tube de 50 mL (réf. 25846), dans lequel 5 mL d’eau ont été ajoutés. Ensuite, les échantillons ont été passés au vortex, à haute vitesse, jusqu’à ce que tous les morceaux de bonbons gélifiés soient solubilisés. La solution a ensuite été dopée avec les analytes cibles et/ou les standards internes (les standards internes n’ont été utilisés que pour l’analyse des contaminants, pas pour les analyses de puissance) et passée au vortex à nouveau pendant 30 secondes. Ensuite, 5 mL d’acétonitrile acidifié (avec de l’acide acétique – 1% v:v) ont été ajoutés puis les échantillons ont été passés au vortex pour 30 secondes supplémentaires. Des sels d’extraction QuEChERS Q-sep EN 15662 (réf. 25849) ont ensuite été ajoutés et les échantillons ont été passés à nouveau au vortex puis centrifugés pendant 5 minutes.
Pour les analyses de puissance, 100 µL d’échantillon extrait ont été mélangés avec 900 µL d’une solution eau/acétonitrile 25/75, et 2 µL de la solution ainsi préparée ont été injectés pour analyse par LC-UV. Pour les contaminants analysables par LC, 750 µL d’échantillon extrait ont été mélangés avec 250 µL d’eau, et 2 µL de la solution ainsi préparée ont été injectés pour analyse par LC-MS/MS. Pour les contaminants analysables par GC, 1.9 mL de l’extrait ont été transférés dans un tube dSPE QuEChERS Q-sep contenant un mélange de PSA, GCB et sulfate de magnésium (réf. 26217). Après être passés au vortex puis centrifugés, 500 µL d’extrait ont été mélangés avec 500 µL d’acide acétique à 1% dans l’acétonitrile, et 1 µL de la solution ainsi préparée a été injecté pour analyse par GC-MS/MS.
Quantification
Pour l’analyse des pesticides et des mycotoxines, des solutions de calibration ont été préparées par dopage des analytes et des standards internes dans des aliquotes d’extraits obtenus à partir de blancs de bonbons gélifiés (la solution a été obtenue en mélangeant des extraits de plusieurs blancs de bonbons gélifiés). Le Tableau I montre les volumes de la solution de dopage des analytes cibles et de la solution de standards internes qui ont été ajoutés à chaque aliquote (volume final de la solution de calibration = 3 mL). Pour réaliser les courbes de calibration pour les pesticides analysables par GC, 1.9 mL des solutions de calibration de 3 mL ont été soumis à une purification par dSPE comme cela est décrit dans la section sur la préparation des échantillons. L’exactitude et la précision de la méthode ont été évaluées en dopant un mélange homogénéisé de bonbons gélifiés (après addition d’eau et passage au vortex) à 10, 50, 100 et 500 ng/g en quatre réplicas (Tableau II), et en effectuant la procédure complète de préparation d’échantillons décrite dans la section sur la préparation des échantillons.
Pour l’analyse des cannabinoïdes, les solutions de calibration ont été préparées à 2, 5, 10, 20, 50, 100 et 200 ppm dans une solution acétonitrile:eau 75:25. Les rendements pour les cannabinoïdes ont été évalués en dopant les échantillons de bonbons gélifiés (1 g) solubilisés dans l’eau à 0.2 et 0.5 mg/g (n=2) puis en les extrayant comme décrit précédemment.
Tableau I : Préparation des étalons pour l’analyse des pesticides et des mycotoxines à l’aide d’aliquotes extraits à partir d’échantillons blancs de bonbons gélifiés (volume final de chaque solution de calibration = 3 mL).
| Conc. souhaitée de l’analyte en matrice (ng/g) | Conc. de l’analyte dans l’extrait final en supposant un rendement d’extraction de la matrice à 100% (ng/mL) | µL de solution d’analyte cible ajoutés au blanc extrait | Conc. de l’analyte dans la solution de dopage (ng/mL) | µL du mélange de standards internes à 5000 ng/mL ajoutés au blanc extrait |
| 5 | 1 | 30 | 100 | 24 |
| 20 | 4 | 12 | 1000 | 24 |
| 50 | 10 | 30 | 1000 | 24 |
| 75 | 15 | 45 | 1000 | 24 |
| 150 | 30 | 90 | 1000 | 24 |
| 200 | 40 | 24 | 5000 | 24 |
| 400 | 80 | 48 | 5000 | 24 |
| 700 | 140 | 84 | 5000 | 24 |
Tableau II : Dopage en mycotoxines et pesticides dans les bonbons gélifiés (1 g d’échantillon homogénéisé avec 5 mL d’eau) à différents niveaux de concentration.
| Conc. en matrice (ng/g) | µL de solution d’analyte cible ajoutés aux échantillons homogénéisés dans l’eau | Conc. de l’analyte dans la solution de dopage (ng/mL) | µL du mélange de standards internes à 5000 ng/mL ajoutés aux échantillons homogénéisés dans l’eau |
| 10 | 10 | 1000 | 40 |
| 50 | 50 | 1000 | 40 |
| 100 | 100 | 1000 | 40 |
| 500 | 100 | 5000 | 40 |
Instrument Conditions
L’instrumentation et les conditions d’analyse des pesticides, mycotoxines et cannabinoïdes dans les bonbons gélifiés au cannabis sont présentées dans les Tableaux III, IV et V. Les transitions MRM des contaminants analysables par LC et des contaminants analysables par GC sont présentées respectivement dans les Tableaux VI et VII. Les temps de rétention des cannabinoïdes sont présentés dans le Tableau VIII.
Tableau III : Conditions LC-MS/MS (Pesticides et Mycotoxines).
| Colonne | Raptor ARC-18 2.7 µm, 100 mm x 2.1 mm (réf. 9314A12) | |||
| Précolonne | Précolonne EXP Raptor ARC-18, 2.1 x 5 mm, 2.7µm (réf. 9314A0252) | |||
| Phase mobile A | Eau, formiate d’ammonium 2 mM, 0.1% d’acide formique | |||
| Phase mobile B | Méthanol, formiate d’ammonium 2 mM, 0.1% d’acide formique | |||
| Gradient | Temps (min) | %B | Temps (min) | %B |
| 0 | 5 | 10.5 | 100 | |
| 1.5 | 65 | 10.6 | 5 | |
| 8.5 | 95 | 12.0 | 5 | |
| 9.5 | 100 | – | – | |
| Débit | 0.5 mL/min | |||
| Temp. du four à colonne | 40 °C | |||
| Temp. du passeur d’échantillons | 10 °C | |||
| Volume injecté | 2 μL | |||
| Instrument | Shimadzu LCMS-8060 | |||
Tableau IV : Conditions GC-MS/MS (Pesticides).
| Instrument | Thermo Trace 1310-TSQ 8000 |
| Colonne | Rxi-5ms, 30 m x 0.25 mm DI x 0.25 µm (réf# 13423) |
| Injection Mode | Splitless |
| Inj. Vol. | 1 µL |
| Insert d’injection | Topaz 4.0 mm ID “Single Taper” avec laine (réf# 23447) |
| Volume injecté | 250 °C |
| Débit de split | 14.0 mL/min |
| Temps splitless | 0.50 min |
| Débit de purge | 5 mL/min |
| Four | 90 °C (maintien pendant 1 min) à 310 °C à 25 °C/min (maintien 10 min) |
| Gaz vecteur | He, débit constant |
| Débit | 1.40 mL/min |
| Détecteur | MS/MS |
| Type de méthode | Acquisition – chronométré |
| Mode d’ionisation | Impact électronique (EI) |
| Température de la ligne de transfert | 290 °C |
| Température de la source | 330 °C |
Tableau V : Conditions HPLC-UV (pour l’analyse de puissance en utilisant une méthode d’économie des solvants [3]).
| Instrument | Waters ACQUITY |
| Colonne | Raptor ARC-18, 2.1 x 150 mm, 2.7 µm (réf# 9314A62) |
| Précolonne | Pré-colonne EXP Raptor ARC-18, 2.1 x 5 mm, 2.7µm (réf# 9314A0252) |
| Volume injecté | 2 µL |
| Phase mobile A | Eau, formiate d’ammonium 5 mM, 0.1% d’acide formique |
| Phase mobile B | Acétonitrile, 0.1% d’acide formique |
| Gradient | Isocratique à 75% B |
| Débit | 0.4 mL/min |
| Temp. du four à colonne | 30 °C |
| Temp. du passeur d’échantillons | 10 °C |
| Longueur d’onde | 228 nm |
Tableau VI : Transitions LC-MS/MS
| Nom | Temps de rétention (min) | Ion précurseur | Ion produit 1 | Ion produit 2 |
| Daminozide-D6 | 0.7 | 167.0 | 149.3 | 49.3 |
| Daminozide | 0.7 | 161.1 | 44.1 | 143.2 |
| Acephate | 1.7 | 184.0 | 143.1 | 95.1 |
| Oxamyl | 2.0 | 237.1 | 72.1 | 90.1 |
| Flonicamid | 2.1 | 230.1 | 203.1 | 174.1 |
| Methomyl | 2.1 | 163.1 | 88.1 | 106.1 |
| Thiamethoxam | 2.1 | 292.0 | 211.1 | 181.1 |
| Imidacloprid | 2.3 | 256.1 | 209.1 | 175.1 |
| Mevinphos | 2.4 | 225.1 | 127.1 | 193.2 |
| Acetamiprid | 2.4 | 223.0 | 126.1 | 56.1 |
| Dimethoathe-D6 | 2.4 | 236.1 | 205.1 | – |
| Dimethoate | 2.4 | 230.0 | 199.1 | 125.1 |
| Thiacloprid | 2.5 | 253.0 | 126.0 | 90.1 |
| Aflatoxin G2 | 2.5 | 331.2 | 189.3 | 115.2 |
| Aflatoxin G1 | 2.5 | 329.2 | 243.2 | 215.3 |
| Aldicarb | 2.6 | 116.0 | 89.2 | 70.2 |
| Aflatoxin B2 | 2.6 | 315.3 | 287.2 | 243.3 |
| Dichlorvos | 2.7 | 220.9 | 109.1 | 79.2 |
| Dichlorvos-D6 | 2.7 | 227.0 | 115.1 | – |
| Aflatoxin B1 | 2.7 | 313.2 | 241.2 | 128.2 |
| Imazalil | 2.7 | 297.0 | 159.0 | 201.0 |
| Carbofuran | 2.7 | 222.1 | 123.1 | 165.2 |
| Propoxur | 2.7 | 210.1 | 111.1 | 93.1 |
| Carbaryl-D7 | 2.8 | 209.2 | 152.2 | – |
| Carbaryl | 2.8 | 202.1 | 145.1 | 127.1 |
| Diuron-D6 | 3.0 | 239.1 | 78.2 | – |
| Atrazine-D5 | 3.0 | 221.2 | 179.1 | – |
| Naled | 3.1 | 397.8 | 127.1 | 109.1 |
| Metalaxyl | 3.1 | 280.2 | 220.2 | 192.2 |
| Spiroxamine | 3.1 | 298.3 | 144.2 | 100.2 |
| Chlorantraniliprole | 3.2 | 483.9 | 452.9 | 285.9 |
| Phosmet | 3.2 | 318.0 | 160.1 | 77.2 |
| Azoxystrobin | 3.3 | 404.0 | 372.1 | 344.1 |
| Linuron-D6 | 3.3 | 255.1 | 160.1 | – |
| Fludioxonil* | 3.4 | 247.0 | 180.0 | 126.0 |
| Methiocarb | 3.4 | 226.1 | 169.1 | 121.1 |
| Dimethomorph | 3.5 | 388.2 | 301.2 | 165.3 |
| Boscalid | 3.5 | 342.9 | 307.1 | 140.1 |
| Paclobutrazol | 3.6 | 294.3 | 70.1 | 125.1 |
| Malathion | 3.6 | 331.0 | 127.2 | 285.2 |
| Myclobutanil | 3.7 | 289.1 | 70.1 | 125.1 |
| Bifenazate | 3.7 | 301.0 | 198.1 | 170.2 |
| Ochratoxin A | 3.8 | 404.2 | 239.1 | 358.3 |
| Fenhexamid | 3.9 | 302.1 | 97.1 | 55.2 |
| Spirotetramat | 4.0 | 374.2 | 302.1 | 216.1 |
| Ethoprophos | 4.1 | 243.1 | 131.1 | 97.1 |
| Fipronil* | 4.1 | 436.8 | 331.8 | 251.9 |
| Fenoxycarb | 4.2 | 302.1 | 88.1 | 116.1 |
| Kresoxim methyl | 4.4 | 314.2 | 267.2 | 222.2 |
| Tebuconazole | 4.4 | 308.1 | 70.1 | 125.1 |
| Diazinon-D10 | 4.6 | 315.2 | 170.2 | – |
| Spinosad (spinosyn A) | 4.6 | 732.4 | 142.2 | 98.1 |
| Diazinon | 4.6 | 305.1 | 169.2 | 153.2 |
| Coumaphos | 4.7 | 363.1 | 227.1 | 307.1 |
| Pyridaben | 4.7 | 365.1 | 309.2 | 147.2 |
| Propiconazole | 4.7 | 342.0 | 159.0 | 69.2 |
| Clofentezine | 4.8 | 303.0 | 138.1 | 102.1 |
| Spinosad (spinosyn D) | 5.0 | 746.5 | 142.3 | 98.4 |
| Spinetoram (spinosyn J) | 5.1 | 748.5 | 142.3 | 98.3 |
| Trifloxystrobin | 5.3 | 409.2 | 186.1 | 145.1 |
| Prallethrin | 5.3 | 301.2 | 123.2 | 105.2 |
| Pyrethrin II | 5.5 | 373.1 | 161.1 | 133.2 |
| Spinetoram (spinosyn L) | 5.6 | 760.5 | 142.2 | 98.1 |
| Piperonyl butoxide | 6.0 | 356.3 | 177.2 | 119.2 |
| Chlorpyrifos | 6.1 | 349.9 | 198.0 | 97.1 |
| Hexythiazox | 6.2 | 353.1 | 228.1 | 168.1 |
| Etoxazole | 6.6 | 360.2 | 141.1 | 304.2 |
| Spiromesifen | 6.7 | 273.2 | 255.2 | 187.2 |
| Pyrethrin I | 6.9 | 329.2 | 161.2 | 105.2 |
| Cyfluthrin (qualifier) | 6.9 | 453.1 | 193.2 | – |
| Cyfluthrin | 6.9 | 451.1 | 191.2 | – |
| Cypermethrin | 7.1 | 433.1 | 191.0 | 416.0 |
| (E)-Fenpyroximate | 7.1 | 422.2 | 366.1 | 138.1 |
| Permethrin-trans | 7.6 | 408.3 | 183.2 | 355.1 |
| Permethrin-cis | 7.9 | 408.3 | 183.2 | 355.1 |
| Avermectin B1a | 7.9 | 890.5 | 305.4 | 567.4 |
| Etofenprox | 8.0 | 394.3 | 177.2 | 359.3 |
| Bifenthrin | 8.2 | 440.0 | 181.2 | 166.2 |
| Acequinocyl precursor ion 1 | 9.4 | 402.3 | 343.2 | 189.0 |
| Acequinocyl precursor ion 2 | 9.4 | 386.0 | 344.2 | 189.1 |
*Analyses réalisées en mode négatif.
Tableau VII : transitions GC-MS/MS.
| Nom | Temps de rétention (min) | Polarité | Ion précurseur | Ion produit |
| Atrazine-D5 (IS) (Quan) | 6.82 | Positive | 220.0 | 58.0 |
| Atrazine-D5 (IS) (Qual) | 6.82 | Positive | 205.0 | 127.0 |
| Diazinon-D10 (Quan) | 7.01 | Positive | 183.0 | 139.0 |
| Diazinon-D10 (Qual) | 7.01 | Positive | 183.0 | 168.0 |
| Quintozene (PCNB) (Quan) | 7.03 | Positive | 294.9 | 236.9 |
| Quintozene (PCNB) (Qual) | 7.03 | Positive | 236.8 | 118.9 |
| Methyl parathion (Quan) | 7.50 | Positive | 263.0 | 109.0 |
| Methyl parathion (Qual) | 7.50 | Positive | 263.0 | 79.0 |
| Captan (Quan) | 8.37 | Positive | 184.0 | 149.1 |
| Captan (Qual) | 8.37 | Positive | 184.0 | 134.1 |
| trans-Chlordane (Quan) | 8.41 | Positive | 271.9 | 237.0 |
| trans-Chlordane (Qual) | 8.41 | Positive | 372.9 | 265.9 |
| cis-Chlordane (Quan) | 8.53 | Positive | 372.9 | 265.9 |
| cis-Chlordane (Qual) | 8.53 | Positive | 271.9 | 237.0 |
| Chlorfenapyr (Quan) | 8.80 | Positive | 247.1 | 227.1 |
| Chlorfenapyr (Qual) | 8.80 | Positive | 59.1 | 31.1 |
| Cyfluthrin (Quan) | 10.61 | Positive | 226.0 | 206.0 |
| Cyfluthrin (Qual) | 10.61 | Positive | 163.0 | 127.0 |
| Cypermethrin (Quan) | 10.87 | Positive | 163.0 | 127.1 |
| Cypermethrin (Qual) | 10.87 | Positive | 181.1 | 152.1 |
Table VIII: Cannabinoid Retention Times.
| Compound | Retention Time (min) |
| Cannabidiolic acid (CBDA) | 2.142 |
| Cannabigerol (CBG) | 2.405 |
| Cannabidiol (CBD) | 2.535 |
| Cannabinol (CBN) | 3.776 |
| Delta-9-tetrahydrocannabinol (Delta-9-THC) | 4.753 |
| Tetrahydrocannabinolic acid (THCA) | 6.279 |
Résultats et interprétation
Optimisation de la méthode
Vu la diversité des matrices dérivées du cannabis et les différences dans les caractéristiques chimiques des analytes cibles, de nombreuses stratégies existent pour garantir des résultats précis. L’analyse des pesticides, des mycotoxines et des cannabinoïdes dans les bonbons gélifiés au cannabis, comme l’exige l’État de Californie, nécessitait des conditions expérimentales complètement différentes de celles utilisées dans notre article technique précédent pour l’analyse dans les brownies [4]. Tout d’abord, nous avons observé que l’utilisation des bonbons gélifiés « pulvérisés » (le broyage a été effectué à l’aide de neige carbonique et d’un robot culinaire) peut se révéler extrêmement difficile car la matrice devient extrêmement collante une fois revenue à température ambiante. Pour cette raison, couper les bonbons gélifiés en petits morceaux s’est avéré être une bien meilleure alternative, qui a facilité la pesée exacte de l’échantillon.
Le défi suivant a consisté à trouver la meilleure approche pour dissoudre la matrice avant son extraction afin d’obtenir des données fiables. Comme l’échantillon était découpé en petits morceaux de taille aléatoire, avoir une matrice homogène était crucial pour garantir une reproductibilité satisfaisante de la méthode. Tout d’abord, nous avons évalué l’utilisation de solvants tels que l’acétonitrile et le méthanol pour dissoudre les morceaux de bonbons gélifiés, et pour extraire les analytes d’intérêt (comme une simple extraction par solvant). Cependant, nous avons constaté qu’il était très difficile de solubiliser la matrice dans ces conditions. Nous avons également évalué l’utilisation du DMSO à cette fin. Même si tous les morceaux de bonbons gélifiés ont été facilement dissous dans ce solvant, le daminozide n’a été détecté dans aucun des extraits en raison de la suppression ionique due au faible pourcentage de DMSO restant dans les échantillons injectés. Après ces tests, nous avons conclu que l’hydratation de l’échantillon avec 5 ml d’eau suivie d’un mélange vigoureux au vortex était le meilleur moyen d’obtenir un échantillon homogène. Par la suite, pour extraire tous les contaminants de la matrice, 5 ml d’acétonitrile acidifié à 1 % avec de l’acide acétique ont été ajoutés à l’échantillon dissous.
Pour séparer la phase organique de la phase, trois sels d’extraction QuEChERS Q-sep différents ont été comparés : AOAC (réf. 25851), non tamponné (réf. 25847), et EN (réf. 25849). ELes sels EN ont donné les meilleurs résultats, avec tous les composés ayant des rendements supérieurs à 83 %, à l’exception du daminozide et de son analogue deutéré, qui ont montré des rendements d’environ 25 %. Pour l’étape de nettoyage/purification, quatre mélanges différents de sorbants QuEChERS dSPE Q-sep (réf. 26215, 26216, 26217, 26242) ont été évalués pour tous les pesticides analysables par LC-MS. Il a été confirmé que tous les mélanges contenant 25 mg de PSA (réf. 26215, 26216, 26217) entraînaient des pertes importantes de daminozide et d’ochratoxine A avec des rendements de l’ordre de 40 %. Le mélange dSPE contenant du MgSO4 et du C18 (réf. 26242) n’a pas entraîné de pertes significatives de pesticides ; malgré tout, nous avons décidé d’évaluer la pertinence d’utiliser l’extrait organique sans aucune autre étape de nettoyage/purification pour la quantification des composés analysables par LC.
Pour évaluer la faisabilité de l’analyse directe des extraits, des expériences visant à étudier les effets matrice dans les extraits de bonbons gélifiés sans aucune étape de nettoyage/purification ont été menées en utilisant la méthodologie proposée par Matuszweski et al. [5]. Les extraits obtenus à partir d’échantillons “blancs” ont été dopés à des concentrations finales de 5, 15 et 50 ppb, et leurs réponses ont été comparées au solvant pur dopé avec les mêmes niveaux de concentration à l’aide d’une analyse LC-MS/MS. À 5 ppb, 12 pesticides ont montré des effets matrice supérieurs à 120 %, et à 15 ppb et 50 ppb, seul le daminozide a montré un gain significatif (Tableau IX). De par ces informations et à cause du faible rendement obtenu pour le daminozide, l’utilisation du daminozide-d6 comme étalon interne a donc été cruciale pour obtenir des données fiables.
Concernant les rendements des pesticides analysables par GC, les données correspondant à l’évaluation de trois mélanges de sorbants dSPE (réf. 26215, 26216, et 26217) ont montré que, dans tous les cas, les rendements étaient supérieurs à 96 % lorsque l’on compare la réponse de l’extrait purifié par rapport à la réponse de l’extrait d’origine. Compte tenu de la teneur élevée en sucre et en pigments des extraits de bonbons gélifiés, le sorbant dSPE contenant du PSA, du GCB et du sulfate de magnésium (réf. 26217) a été choisi pour le protocole final de préparation des échantillons.
Vérification de la méthode
Le Tableau X présente les résultats correspondant aux limites de quantification, à la linéarité, à l’exactitude et à la précision pour la liste californienne des pesticides et des mycotoxines déterminées dans une matrice gommeuse. Pour tous les contaminants analysés par LC-MS/MS, des courbes de calibration ont été tracées en utilisant des rapports de réponses analyte/étalon interne et un facteur de pondération de 1/x. Pour les composés analysables par GC, seule la courbe de calibration du PCNB a été tracée en utilisant le rapport analyte/étalon interne, le diazinon-d10 étant choisi comme étalon interne. Pour le reste des composés analysables par GC, la quantification a été effectuée avec des courbes de calibration externes (aire/surface par rapport à la concentration dopée) car cela a fourni de meilleurs résultats qu’avec l’étalon interne. Des valeurs de RSD inférieures à 24 % ont été obtenues pour tous les analytes à tous les niveaux de concentration testés. Les valeurs de précision étaient comprises entre 75 et 118 % et les coefficients de détermination (R²) étaient tous supérieurs à 0,99.
Enfin, les résultats de l’analyse des cannabinoïdes ont démontré que l’extrait collecté pour la détermination des contaminants convient également aux analyses de puissance. Le Tableau XI présente les données correspondant aux courbes de calibration préparées en solvant et qui ont été utilisées pour la quantification de chaque cannabinoïde. Comme le montre le Tableau XII, les échantillons de bonbons gélifiés dopés avec six cannabinoïdes à 0,2 mg/g ont présenté des rendements allant de 99 à 107 %, tandis que les échantillons dopés à 0,5 mg/g ont montré des rendements de 99 à 106 %. Des chromatogrammes représentatifs sont présentés dans les Figures 2 à 4.
Tableau IX : Effets Matrice (EM) pour les pesticides et les mycotoxines dans les bonbons gélifiés au cannabis.
| EM à 5 ppb (%) | RSD | EM à 15 ppb (%) | RSD | EM à 50 ppb (%) | RSD | |
| Daminozide | 216 | 3 | 251 | 7 | 185 | 3 |
| Acephate | 95 | 6 | 85 | 1 | 89 | 6 |
| Oxamyl | 105 | 5 | 96 | 2 | 98 | 5 |
| Flonicamid | 91 | 32 | 90 | 22 | 97 | 17 |
| Methomyl | 104 | 4 | 92 | 3 | 99 | 4 |
| Thiamethoxam | 105 | 5 | 92 | 5 | 96 | 5 |
| Imidacloprid | 114 | 9 | 87 | 9 | 100 | 9 |
| Mevinphos | 102 | 6 | 93 | 3 | 93 | 6 |
| Acetamiprid | 100 | 2 | 88 | 0 | 91 | 2 |
| Dimethoate | 97 | 3 | 92 | 3 | 93 | 3 |
| Thiacloprid | 109 | 7 | 93 | 1 | 93 | 7 |
| Aflatoxin G2 | 102 | 6 | 86 | 0 | 93 | 6 |
| Aflatoxin G1 | 106 | 7 | 93 | 1 | 91 | 7 |
| Aldicarb | 81 | 22 | 85 | 14 | 90 | 22 |
| Aflatoxin B2 | 113 | 11 | 79 | 9 | 95 | 11 |
| Dichlorvos | 126 | 15 | 90 | 6 | 92 | 15 |
| Aflatoxin B1 | 104 | 9 | 93 | 5 | 95 | 9 |
| Imazalil | 92 | 1 | 96 | 3 | 98 | 1 |
| Carbofuran | 106 | 3 | 98 | 1 | 102 | 3 |
| Propoxur | 104 | 3 | 96 | 4 | 96 | 3 |
| Carbaryl | 103 | 4 | 99 | 8 | 93 | 4 |
| Naled | 101 | 4 | 94 | 2 | 84 | 4 |
| Metalaxyl | 105 | 3 | 97 | 2 | 97 | 3 |
| Spiroxamine | 105 | 4 | 94 | 1 | 97 | 4 |
| Chlorantraniliprole | 114 | 6 | 88 | 5 | 100 | 6 |
| Phosmet | 108 | 10 | 100 | 6 | 92 | 10 |
| Azoxystrobin | 104 | 1 | 94 | 1 | 94 | 1 |
| Fludioxonil | 101 | 7 | 90 | 11 | 94 | 7 |
| Methiocarb | 102 | 5 | 94 | 3 | 95 | 5 |
| Dimethomorph | 108 | 15 | 93 | 0 | 93 | 15 |
| Boscalid | 119 | 11 | 94 | 4 | 85 | 11 |
| Paclobutrazol | 110 | 10 | 90 | 2 | 92 | 10 |
| Malathion | 101 | 3 | 92 | 4 | 95 | 3 |
| Myclobutanil | 92 | 11 | 93 | 0 | 95 | 11 |
| Bifenazate | 105 | 2 | 98 | 4 | 99 | 2 |
| Ochratoxin A | 111 | 10 | 111 | 0 | 98 | 10 |
| Fenhexamid | 135 | 6 | 102 | 0 | 91 | 6 |
| Spirotetramat | 107 | 7 | 87 | 5 | 95 | 7 |
| Ethoprophos | 104 | 5 | 97 | 2 | 96 | 5 |
| Fipronil | 99 | 12 | 93 | 9 | 96 | 12 |
| Fenoxycarb | 108 | 9 | 97 | 1 | 93 | 9 |
| Kresoxim methyl | 93 | 21 | 108 | 3 | 90 | 21 |
| Tebuconazole | 102 | 6 | 95 | 3 | 97 | 6 |
| Spinosyn A | 100 | 5 | 98 | 2 | 95 | 5 |
| Diazinon | 107 | 2 | 95 | 1 | 96 | 2 |
| Coumaphos | 114 | 7 | 94 | 3 | 97 | 7 |
| Pyridaben | 139 | 18 | 103 | 15 | 94 | 18 |
| Propiconazole | 106 | 2 | 97 | 1 | 95 | 2 |
| Clofentezine | 126 | 14 | 87 | 3 | 92 | 14 |
| Spinosyn D | 104 | 8 | 93 | 8 | 97 | 8 |
| Spinosyn J | 110 | 6 | 92 | 6 | 101 | 6 |
| Trifloxystrobin | 103 | 2 | 95 | 2 | 101 | 2 |
| Prallethrin | 101 | 17 | 103 | 0 | 98 | 17 |
| Pyrethrin II | 92 | 23 | 82 | 5 | 101 | 23 |
| Spinosyn L | 106 | 6 | 95 | 0 | 98 | 6 |
| Piperonyl butoxide | 103 | 2 | 97 | 0 | 96 | 2 |
| Chlorpyrifos | 105 | 10 | 93 | 0 | 91 | 10 |
| Hexythiazox | 121 | 15 | 96 | 0 | 86 | 15 |
| Etoxazole | 102 | 1 | 95 | 1 | 95 | 1 |
| Spiromesifen | 112 | 6 | 95 | 5 | 100 | 6 |
| Pyrethrin I | 131 | 13 | 97 | 4 | 95 | 13 |
| Cyfluthrin | – | – | – | – | 80 | 8 |
| Cypermethrin | – | – | 95 | 16 | 96 | 16 |
| (E)-Fenpyroximate | 107 | 6 | 95 | 4 | 94 | 6 |
| Permethrin-trans | 136 | 22 | 103 | 4 | 94 | 22 |
| Permethrin-cis | 113 | 12 | 98 | 8 | 101 | 12 |
| Avermectin B1a | 122 | 17 | 96 | 0 | 87 | 17 |
| Etofenprox | 110 | 4 | 100 | 2 | 101 | 4 |
| Bifenthrin | 135 | 5 | 98 | 6 | 85 | 5 |
| Acequinocyl | 129 | 5 | 95 | 5 | 78 | 5 |
Tableau X : LQ, linéarité, exactitude et précision pour les pesticides et mycotoxines dans les bonbons gélifiés au cannabis.
| Contaminant | Niveau d’action (ng/g) | LOQ (ng/g) | R2 | 10 ng/g (n=4) | 50 ng/g (n=4) | 100 ng/g (n=4) | 500 ng/g (n=4) | ||||
| Exactitude (%) | Précision (RSD) | Exactitude (%) | Précision (RSD) | Exactitude (%) | Précision (RSD) | Exactitude (%) | Précision (RSD) | ||||
| Daminozide* | <LOD | 20 | 0.9999 | – | – | 114 | 6 | 114 | 4 | 116 | 4 |
| Acephate | 5000 | 5 | 0.9996 | 100 | 4 | 93 | 3 | 90 | 2 | 88 | 2 |
| Oxamyl | 200 | 5 | 0.999 | 108 | 1 | 102 | 3 | 105 | 4 | 99 | 3 |
| Flonicamid | 2000 | 50 | 0.999 | – | – | 117 | 6 | 105 | 11 | 101 | 4 |
| Methomyl | 100 | 20 | 0.9989 | – | – | 102 | 3 | 103 | 3 | 100 | 1 |
| Thiamethoxam | 4500 | 10 | 0.9988 | 112 | 23 | 108 | 5 | 108 | 6 | 100 | 3 |
| Imidacloprid | 3000 | 10 | 0.9985 | 105 | 17 | 107 | 3 | 109 | 4 | 102 | 5 |
| Mevinphos (I and II)* | <LOD | 20 | 0.9981 | – | – | 101 | 4 | 104 | 7 | 101 | 3 |
| Acetamiprid | 5000 | 10 | 0.9968 | 100 | 8 | 108 | 6 | 109 | 5 | 105 | 1 |
| Dimethoate* | <LOD | 5 | 0.9994 | 109 | 15 | 104 | 3 | 101 | 5 | 99 | 2 |
| Thiacloprid* | <LOD | 20 | 0.9981 | – | – | 100 | 1 | 103 | 4 | 103 | 3 |
| Aflatoxin G2 | 20# | 5 | 0.9957 | 112 | 17 | 101 | 6 | 97 | 2 | – | – |
| Aflatoxin G1 | 20# | 5 | 0.9984 | 114 | 9 | 98 | 1 | 100 | 4 | – | – |
| Aldicarb* | <LOD | 20 | 0.9971 | – | – | 91 | 17 | 104 | 8 | 97 | 4 |
| Aflatoxin B2 | 20# | 5 | 0.9973 | 97 | 23 | 107 | 6 | 94 | 7 | – | – |
| Dichlorvos* | <LOD | 10 | 0.9984 | 98 | 17 | 103 | 4 | 97 | 18 | 106 | 4 |
| Aflatoxin B1 | 20# | 5 | 0.9978 | 113 | 5 | 101 | 6 | 96 | 5 | – | – |
| Imazalil* | <LOD | 5 | 0.9977 | 97 | 19 | 109 | 5 | 107 | 4 | 105 | 3 |
| Carbofuran* | <LOD | 5 | 0.9973 | 93 | 7 | 108 | 1 | 109 | 5 | 99 | 4 |
| Propoxur* | <LOD | 5 | 0.9977 | 108 | 6 | 108 | 2 | 107 | 4 | 102 | 3 |
| Carbaryl | 500 | 5 | 0.9988 | 95 | 14 | 109 | 6 | 108 | 5 | 102 | 2 |
| Naled | 500 | 5 | 0.9968 | 98 | 4 | 112 | 8 | 110 | 3 | 101 | 5 |
| Metalaxyl | 15,000 | 5 | 0.9988 | 101 | 5 | 105 | 4 | 106 | 5 | 99 | 3 |
| Spiroxamine* | <LOD | 5 | 0.9977 | 104 | 6 | 106 | 2 | 105 | 2 | 101 | 3 |
| Chlorantraniliprole | 40,000 | 20 | 0.9971 | – | – | 93 | 7 | 104 | 6 | 104 | 5 |
| Phosmet | 200 | 5 | 0.9992 | 109 | 14 | 105 | 3 | 104 | 3 | 100 | 4 |
| Azoxystrobin | 40,000 | 5 | 0.9992 | 100 | 3 | 104 | 1 | 105 | 4 | 102 | 3 |
| Fludioxonil | 30,000 | 20 | 0.9949 | – | – | 109 | 13 | 97 | 6 | 101 | 6 |
| Methiocarb* | <LOD | 5 | 0.9988 | 116 | 16 | 105 | 5 | 107 | 5 | 101 | 4 |
| Dimethomorph (I and II) | 20,000 | 10 | 0.999 | 75 | 14 | 101 | 6 | 93 | 8 | 101 | 5 |
| Boscalid | 10,000 | 10 | 0.9964 | 108 | 15 | 102 | 12 | 102 | 2 | 103 | 3 |
| Paclobutrazol* | <LOD | 10 | 0.9979 | 99 | 9 | 106 | 1 | 108 | 3 | 100 | 4 |
| Malathion | 5000 | 10 | 0.9989 | 117 | 12 | 112 | 3 | 106 | 2 | 101 | 3 |
| Myclobutanil | 9000 | 10 | 0.9986 | 102 | 22 | 102 | 6 | 104 | 3 | 101 | 3 |
| Bifenazate | 5000 | 10 | 0.9994 | 118 | 20 | 110 | 3 | 104 | 10 | 102 | 5 |
| Ochratoxin A | 20 | 10 | 0.9957 | 99 | 8 | 99 | 24 | 104 | 8 | – | – |
| Fenhexamid | 10,000 | 10 | 0.9969 | 96 | 21 | 109 | 4 | 106 | 3 | 107 | 5 |
| Spirotetramat | 13,000 | 10 | 0.9987 | 83 | 18 | 107 | 6 | 106 | 3 | 105 | 3 |
| Ethoprophos* | <LOD | 5 | 0.9985 | 101 | 3 | 106 | 4 | 104 | 1 | 102 | 3 |
| Fipronil* | <LOD | 20 | 0.998 | – | – | 96 | 5 | 104 | 8 | 103 | 4 |
| Fenoxycarb* | <LOD | 10 | 0.9967 | 115 | 5 | 106 | 4 | 107 | 2 | 102 | 3 |
| Kresoxym-methyl | 1000 | 10 | 0.9993 | 112 | 20 | 104 | 10 | 102 | 4 | 103 | 3 |
| Tebuconazole | 2000 | 5 | 0.999 | 100 | 3 | 110 | 1 | 105 | 3 | 101 | 4 |
| Spinosad- spinosyn A (71 %)a | 3000¥ | 7.1 | 0.9988 | 117 | 2 | 110 | 3 | 108 | 2 | 102 | 1 |
| Diazinon | 200 | 5 | 0.9997 | 104 | 1 | 102 | 1 | 104 | 2 | 101 | 1 |
| Coumaphos* | <LOD | 10 | 0.9991 | 107 | 11 | 109 | 5 | 108 | 2 | 103 | 2 |
| Pyridaben | 3000 | 50 | 0.9994 | – | – | 93 | 12 | 113 | 6 | 103 | 1 |
| Propiconazole | 20,000 | 5 | 0.9991 | 96 | 6 | 108 | 4 | 104 | 5 | 103 | 3 |
| Clofentezine | 500 | 20 | 0.9978 | – | – | 102 | 5 | 105 | 3 | 106 | 4 |
| Spinosad – spinosyn D (29%)b | 3000¥ | 2.9 | 0.9993 | 106 | 8 | 101 | 2 | 103 | 5 | 104 | 4 |
| Spinetoram – spinosyn J (80%)c | 3000§ | 4 | 0.9995 | 104 | 7 | 102 | 3 | 108 | 4 | 102 | 2 |
| Trifloxystrobin | 30,000 | 5 | 0.9996 | 107 | 3 | 106 | 3 | 106 | 3 | 104 | 2 |
| Prallethrin | 400 | 10 | 0.9967 | 107 | 21 | 99 | 16 | 111 | 6 | 101 | 3 |
| Pyrethrin II (34%)f | 1000£ | 17 | 0.9977 | – | – | 94 | 11 | 112 | 4 | 106 | 6 |
| Spinetoram – spinosyn L (20%)d | 3000§ | 2 | 0.9993 | 107 | 10 | 109 | 4 | 107 | 3 | 102 | 1 |
| Piperonyl Butoxide | 8000 | 5 | 0.9998 | 110 | 5 | 99 | 2 | 94 | 3 | 95 | 5 |
| Chlorpyrifos* | <LOD | 20 | 0.9995 | – | – | 103 | 9 | 106 | 4 | 104 | 5 |
| Hexythiazox | 2000 | 10 | 0.9975 | 104 | 15 | 102 | 3 | 107 | 4 | 106 | 5 |
| Etoxazole | 1500 | 5 | 0.9995 | 103 | 4 | 104 | 2 | 103 | 1 | 100 | 1 |
| Spiromesifen | 12,000 | 5 | 0.9992 | 98 | 8 | 109 | 7 | 111 | 2 | 102 | 2 |
| Pyrethrin I (54%)e | 1000£ | 11 | 0.9977 | – | – | 98 | 5 | 105 | 12 | 104 | 5 |
| Cyfluthrin | 1000 | 50 | 0.999 | – | – | 93 | 11 | 102 | 23 | 115 | 10 |
| Cypermethrin | 1000 | 50 | 0.9961 | – | – | 115 | 11 | 98 | 18 | 104 | 6 |
| (E)-Fenpyroximate | 2000 | 5 | 0.9995 | 102 | 9 | 109 | 3 | 109 | 2 | 105 | 2 |
| Permethrin-trans (59%)h | 20,000¢ | 12 | 0.9994 | – | – | 99 | 8 | 104 | 5 | 101 | 3 |
| Permethrin-cis (41%)g | 20,000¢ | 8 | 0.9996 | 95 | 5 | 104 | 5 | 103 | 4 | 101 | 3 |
| Avermectin B1a | 300 | 50 | 0.9988 | – | – | 114 | 3 | 108 | 2 | 105 | 2 |
| Etofenprox* | <LOD | 5 | 0.9994 | 104 | 7 | 107 | 1 | 106 | 2 | 103 | 1 |
| Bifenthrin | 500 | 5 | 0.999 | 99 | 5 | 103 | 2 | 108 | 6 | 104 | 2 |
| Acequinocyl | 4000 | 10 | 0.9997 | 104 | 7 | 109 | 3 | 108 | 3 | 106 | 2 |
| Quintozene (PCNB) (GC) | 200 | 10 | 0.9966 | 110 | 14 | 102 | 5 | 101 | 1 | 97 | 3 |
| Methyl parathion (GC)* | <LOD | 5 | 0.9934 | 89 | 10 | 89 | 5 | 87 | 3 | 89 | 6 |
| Captan (GC) | 5000 | 10 | 0.9924 | 110 | 14 | 96 | 10 | 94 | 18 | 92 | 7 |
| Chlordane (GC)* | <LOD | 20 | 0.9913 | – | – | 105 | 9 | 93 | 8 | 85 | 10 |
| Chlorfenapyr (GC)* | <LOD | 10 | 0.9924 | 97 | 9 | 90 | 19 | 89 | 6 | 85 | 13 |
| Cyfluthrin (GC) | 1000 | 5 | 0.9935 | 107 | 10 | 92 | 18 | 91 | 7 | 89 | 11 |
| Cypermethrin (GC) | 1000 | 5 | 0.9938 | 95 | 9 | 83 | 17 | 97 | 15 | 93 | 9 |
*Pesticides de catégorie I, LQ≤100 ng/g
aSpinosad- spinosyn A: Conc. 1: 7 ng/g; Conc. 2: 35.5 ng/g; Conc. 3: 71 ng/g; Conc. 4: 355 ng/g
bSpinosad – spinosyn D: Conc. 1: 3 ng/g; conc. 2: 14.5 ng/g; Conc. 3: 29 ng/g; Conc. 4: 145 ng/g
cSpinetoram – spinosyn J: Conc. 1: 8 ng/g; Conc. 2: 40 ng/g; Conc. 3: 80 ng/g; Conc. 4: 400 ng/g
dSpinetoram – spinosyn L: Conc. 1: 2 ng/g; Conc. 2: 10 ng/g; Conc. 3: 20 ng/g; Conc. 4: 100 ng/g
ePyrethrin I: Conc. 1: 5 ng/g; Conc. 2: 27 ng/g; Conc. 3: 54 ng/g; Conc. 4: 270 ng/g
fPyrethrin II: Conc. 1: 3 ng/g; Conc. 2: 17 ng/g; Conc. 3: 34 ng/g; Conc. 4: 170 ng/g
gPermethrin-cis: Conc. 1: 4 ng/g; Conc. 2: 20.5 ng/g; Conc. 3: 41 ng/g; Conc. 4: 205 ng/g
hPermethrin-trans: Conc. 1: 6 ng/g; Conc. 2: 29.5 ng/g; Conc. 3: 59 ng/g; Conc. 4: 295 ng/g
#Le total en aflatoxines B1, B2, G1 et G2 ne doit pas excéder 20 ng/g.
¥Le spinosad total ne doit pas excéder 3 000 ng/g.
§Le spinétorame total ne doit pas excéder 3 000ng/g.
£ Le total en pyréthrines ne doit pas excéder 1 000ng/g.
¢Le total en perméthrines ne doit pas excéder 20 000ng/g.
Tableau XI : Linéarité pour les cannabinoïdes dan les bonbons gélifiés au cannabis.
| Cannabinoïdes | Temps de rétention | R2 | Equation |
| Cannabidiolic acid (CBDA) | 2.142 | 0.9993 | y = 2.08e+004x + 1.03e+003 |
| Cannabigerol (CBG) | 2.405 | 0.9981 | y = 1.16e+004x + 1.85e+003 |
| Cannabidiol (CBD) | 2.535 | 0.9972 | y = 1.17e+004x + 1.42e+003 |
| Cannabinol (CBN) | 3.776 | 0.9980 | y = 2.70e+004x + 6.14e+004 |
| Delta-9-tetrahydrocannabinol (Delta-9-THC) | 4.753 | 0.9970 | y = 1.06e+004x + 7.29e+003 |
| Tetrahydrocannabinolic acid (THCA) | 6.279 | 0.9986 | y = 1.78e+004x – 1.28e+003 |
Tableau XII : Exactitude et précision pour les cannabinoïdes dans les bonbons gélifiés au cannabis.
| Cannabinoïdes/niveau de dopage | Concentration de l’extrait dilué (ppm) | Moyenne (ppm) | SD | RSD (%) | Concentration de l’extrait non dilué (ppm) | Concentration estimée de l’échantillon (mg/g) | Exactitude (%) | Pourcentage d’erreur | |
| Bonbon dopé à 0.2 mg/g | Replicate 1 | Replicate 2 | |||||||
| Cannabidiolic acid (CBDA) | 4.2 | 4.4 | 4.3 | 0.1 | 3 | 43 | 0.2 | 107 | 7 |
| Cannabigerol (CBG) | 4.0 | 3.9 | 4.0 | 0.1 | 2 | 40 | 0.2 | 99 | 1 |
| Cannabidiol (CBD) | 4.1 | 4.2 | 4.1 | 0.1 | 2 | 41 | 0.2 | 103 | 3 |
| Cannabinol (CBN) | 4.0 | 4.1 | 4.1 | 0.1 | 3 | 41 | 0.2 | 101 | 1 |
| Delta-9 tetrahydrocannabinol (Delta 9 THC) | 4.0 | 4.2 | 4.1 | 0.1 | 3 | 41 | 0.2 | 103 | 3 |
| Tetrahydrocannabinolic acid (THCA) | 4.1 | 4.3 | 4.2 | 0.1 | 3 | 42 | 0.2 | 105 | 5 |
| Gummy spiked at 0.5 mg/g | |||||||||
| Cannabidiolic acid (CBDA) | 10.4 | 10.7 | 10.6 | 0.2 | 2 | 106 | 0.5 | 106 | 6 |
| Cannabigerol (CBG) | 9.5 | 10.3 | 9.9 | 0.5 | 5 | 99 | 0.5 | 99 | 1 |
| Cannabidiol (CBD) | 9.8 | 10.6 | 10.2 | 0.5 | 5 | 102 | 0.5 | 102 | 2 |
| Cannabinol (CBN) | 9.8 | 10.3 | 10.0 | 0.4 | 4 | 100 | 0.5 | 100 | 0 |
| Delta-9-tetrahydrocannabinol (Delta-9-THC) | 9.9 | 10.3 | 10.1 | 0.3 | 3 | 101 | 0.5 | 101 | 1 |
| Tetrahydrocannabinolic acid (THCA) | 10.3 | 9.9 | 10.1 | 0.2 | 2 | 101 | 0.5 | 101 | 1 |
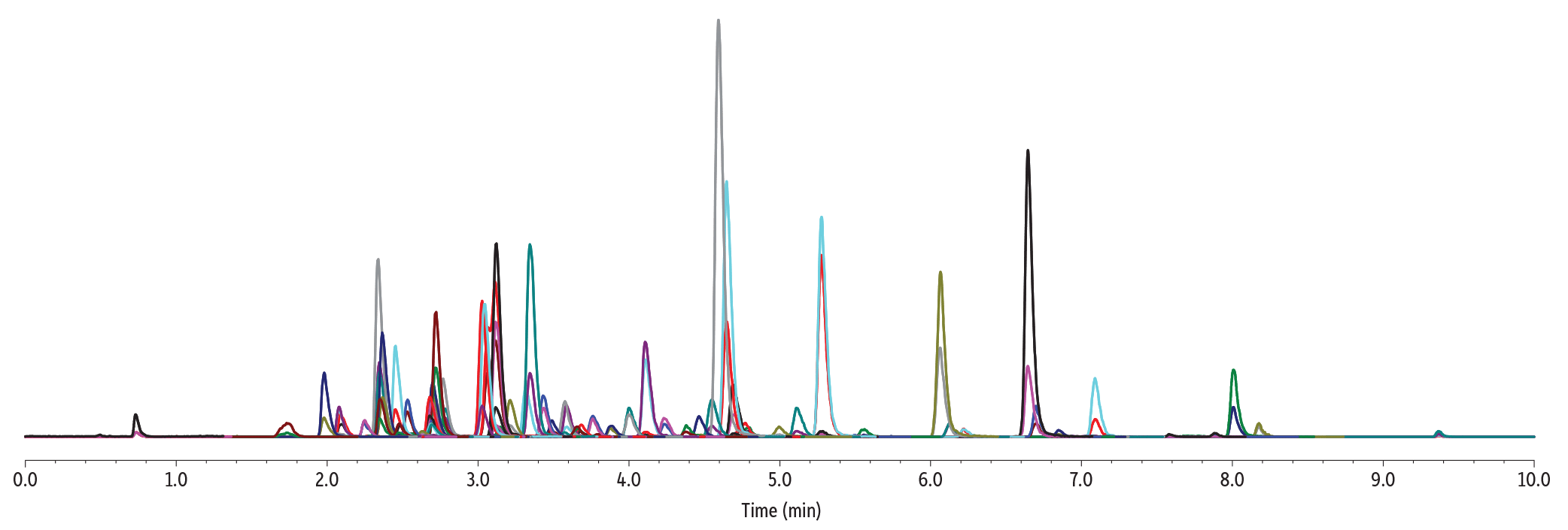
LC_GN0666
Peaks
| Peaks | tR (min) | Precursor Ion | Product Ion 1 | Product Ion 2 | Polarity | |
|---|---|---|---|---|---|---|
| 1. | Daminozide-d6 | 0.7 | 167.0 | 149.3 | 49.3 | + |
| 2. | Daminozide | 0.7 | 161.1 | 44.1 | 143.2 | + |
| 3. | Acephate | 1.7 | 184.0 | 143.1 | 95.1 | + |
| 4. | Oxamyl | 2.0 | 237.1 | 72.1 | 90.1 | + |
| 5. | Flonicamid | 2.1 | 230.1 | 203.1 | 174.1 | + |
| 6. | Methomyl | 2.1 | 163.1 | 88.1 | 106.1 | + |
| 7. | Thiamethoxam | 2.1 | 292.0 | 211.1 | 181.1 | + |
| 8. | Imidacloprid | 2.3 | 256.1 | 209.1 | 175.1 | + |
| 9. | Mevinphos | 2.4 | 225.1 | 127.1 | 193.2 | + |
| 10. | Acetamiprid | 2.4 | 223.0 | 126.1 | 56.1 | + |
| 11. | Dimethoathe-d6 | 2.4 | 236.1 | 205.1 | – | + |
| 12. | Dimethoate | 2.4 | 230.0 | 199.1 | 125.1 | + |
| 13. | Thiacloprid | 2.5 | 253.0 | 126.0 | 90.1 | + |
| 14. | Aflatoxin G2 | 2.5 | 331.2 | 189.3 | 115.2 | + |
| 15. | Aflatoxin G1 | 2.5 | 329.2 | 243.2 | 215.3 | + |
| 16. | Aldicarb | 2.6 | 116.0 | 89.2 | 70.2 | + |
| 17. | Aflatoxin B2 | 2.6 | 315.3 | 287.2 | 243.3 | + |
| 18. | Dichlorvos | 2.7 | 220.9 | 109.1 | 79.2 | + |
| 19. | Dichlorvos-d6 | 2.7 | 227.0 | 115.1 | – | + |
| 20. | Aflatoxin B1 | 2.7 | 313.2 | 241.2 | 128.2 | + |
| 21. | Imazalil | 2.7 | 297.0 | 159.0 | 201.0 | + |
| 22. | Carbofuran | 2.7 | 222.1 | 123.1 | 165.2 | + |
| 23. | Propoxur | 2.7 | 210.1 | 111.1 | 93.1 | + |
| 24. | Carbaryl-d7 | 2.8 | 209.2 | 152.2 | – | + |
| 25. | Carbaryl | 2.8 | 202.1 | 145.1 | 127.1 | + |
| 26. | Diuron-d6 | 3.0 | 239.1 | 78.2 | – | + |
| 27. | Atrazine-d5 | 3.0 | 221.2 | 179.1 | – | + |
| 28. | Naled | 3.1 | 397.8 | 127.1 | 109.1 | + |
| 29. | Metalaxyl | 3.1 | 280.2 | 220.2 | 192.2 | + |
| 30. | Spiroxamine | 3.1 | 298.3 | 144.2 | 100.2 | + |
| 31. | Chlorantraniliprole | 3.2 | 483.9 | 452.9 | 285.9 | + |
| 32. | Phosmet | 3.2 | 318.0 | 160.1 | 77.2 | + |
| 33. | Azoxystrobin | 3.3 | 404.0 | 372.1 | 344.1 | + |
| 34. | Linuron-d6 | 3.3 | 255.1 | 160.1 | – | + |
| 35. | Fludioxonil | 3.4 | 247.0 | 180.0 | 126.0 | – |
| 36. | Methiocarb | 3.4 | 226.1 | 169.1 | 121.1 | + |
| 37. | Dimethomorph | 3.5 | 388.2 | 301.2 | 165.3 | + |
| 38. | Boscalid | 3.5 | 342.9 | 307.1 | 140.1 | + |
| 39. | Paclobutrazol | 3.6 | 294.3 | 70.1 | 125.1 | + |
| 40. | Malathion | 3.6 | 331.0 | 127.2 | 285.2 | + |
| 41. | Myclobutanil | 3.7 | 289.1 | 70.1 | 125.1 | + |
| 42. | Bifenazate | 3.7 | 301.0 | 198.1 | 170.2 | + |
| 43. | Ochratoxin A | 3.8 | 404.2 | 239.1 | 358.3 | + |
| 44. | Fenhexamid | 3.9 | 302.1 | 97.1 | 55.2 | + |
| 45. | Spirotetramat | 4.0 | 374.2 | 302.1 | 216.1 | + |
| 46. | Ethoprophos | 4.1 | 243.1 | 131.1 | 97.1 | + |
| 47. | Fipronil | 4.1 | 436.8 | 331.8 | 251.9 | – |
| 48. | Fenoxycarb | 4.2 | 302.1 | 88.1 | 116.1 | + |
| 49. | Kresoxim-methyl | 4.4 | 314.2 | 267.2 | 222.2 | + |
| 50. | Tebuconazole | 4.4 | 308.1 | 70.1 | 125.1 | + |
| 51. | Diazinon-d10 | 4.6 | 315.2 | 170.2 | – | + |
| 52. | Spinosyn A (Spinosad) | 4.6 | 732.4 | 142.2 | 98.1 | + |
| 53. | Diazinon | 4.6 | 305.1 | 169.2 | 153.2 | + |
| 54. | Coumaphos | 4.7 | 363.1 | 227.1 | 307.1 | + |
| 55. | Pyridaben | 4.7 | 365.1 | 309.2 | 147.2 | + |
| 56. | Propiconazole | 4.7 | 342.0 | 159.0 | 69.2 | + |
| 57. | Clofentezine | 4.8 | 303.0 | 138.1 | 102.1 | + |
| 58. | Spinosyn D (Spinosad) | 5.0 | 746.5 | 142.3 | 98.4 | + |
| 59. | Spinosyn J (Spinetoram) | 5.1 | 748.5 | 142.3 | 98.3 | + |
| 60. | Trifloxystrobin | 5.3 | 409.2 | 186.1 | 145.1 | + |
| 61. | Prallethrin | 5.3 | 301.2 | 123.2 | 105.2 | + |
| 62. | Pyrethrin II | 5.5 | 373.1 | 161.1 | 133.2 | + |
| 63. | Spinosyn L (Spinetoram) | 5.6 | 760.5 | 142.2 | 98.1 | + |
| 64. | Piperonyl butoxide | 6.0 | 356.3 | 177.2 | 119.2 | + |
| 65. | Chlorpyrifos | 6.1 | 349.9 | 198.0 | 97.1 | + |
| 66. | Hexythiazox | 6.2 | 353.1 | 228.1 | 168.1 | + |
| 67. | Etoxazole | 6.6 | 360.2 | 141.1 | 304.2 | + |
| 68. | Spiromesifen | 6.7 | 273.2 | 255.2 | 187.2 | + |
| 69. | Pyrethrin I | 6.9 | 329.2 | 161.2 | 105.2 | + |
| 70. | Cyfluthrin (qualifier) | 6.9 | 453.1 | 193.2 | – | + |
| 71. | Cyfluthrin | 6.9 | 451.1 | 191.2 | – | + |
| 72. | Cypermethrin | 7.1 | 433.1 | 191.0 | 416.0 | + |
| 73. | (E)-Fenpyroximate | 7.1 | 422.2 | 366.1 | 138.1 | + |
| 74. | trans-Permethrin | 7.6 | 408.3 | 183.2 | 355.1 | + |
| 75. | cis-Permethrin | 7.9 | 408.3 | 183.2 | 355.1 | + |
| 76. | Avermectin B1a | 7.9 | 890.5 | 305.4 | 567.4 | + |
| 77. | Etofenprox | 8.0 | 394.3 | 177.2 | 359.3 | + |
| 78. | Bifenthrin | 8.2 | 440.0 | 181.2 | 166.2 | + |
| 79. | Acequinocyl (precursor ion 1) | 9.4 | 402.3 | 343.2 | 189.0 | + |
| 80. | Acequinocyl (precursor ion 2) | 9.4 | 386.0 | 344.2 | 189.1 | + |
Conditions
| Column | Raptor ARC-18 (cat.# 9314A12) | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 100 mm x 2.1 mm ID | ||||||||||||||||||||||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||||||||||
| Guard Column: | Raptor ARC-18 EXP guard column cartridge 5 mm, 2.1 mm ID, 2.7 µm (cat.# 9314A0252) | ||||||||||||||||||||||||||||||||
| Temp.: | 40 °C | ||||||||||||||||||||||||||||||||
| Standard/Sample | |||||||||||||||||||||||||||||||||
| California pesticide standard #1 (cat.# 34124) | |||||||||||||||||||||||||||||||||
| California pesticide standard #2 (cat.# 34125) | |||||||||||||||||||||||||||||||||
| California pesticide standard #3 (cat.# 34126) | |||||||||||||||||||||||||||||||||
| California pesticide standard #4 (cat.# 34127) | |||||||||||||||||||||||||||||||||
| California pesticide standard #5 (cat.# 34128) | |||||||||||||||||||||||||||||||||
| California pesticide standard #6 (cat.# 34129) | |||||||||||||||||||||||||||||||||
| Dimethoate-d6 (cat.# 31988) | |||||||||||||||||||||||||||||||||
| Dichlorvos-d6 (cat.# 31987) | |||||||||||||||||||||||||||||||||
| Carbaryl-d7 (cat.# 31985) | |||||||||||||||||||||||||||||||||
| Diazinon-d10 (cat.# 31986) | |||||||||||||||||||||||||||||||||
| Atrazine-d5 (cat.# 31984) | |||||||||||||||||||||||||||||||||
| Diuron-d6 (cat.# 31989) | |||||||||||||||||||||||||||||||||
| Liuron-d6 (cat.# 31990) | |||||||||||||||||||||||||||||||||
| Aflatoxins standard (cat.# 34121) | |||||||||||||||||||||||||||||||||
| Ochratoxin A (cat.# 34122) | |||||||||||||||||||||||||||||||||
| Compounds not present in these mixes were obtained separately. | |||||||||||||||||||||||||||||||||
| Diluent: | 75:25 Acetonitrile:water | ||||||||||||||||||||||||||||||||
| Conc.: | 3.75-15 ng/mL (Expected concentration range in extract of gummy initially spiked at 100 ng/g.) | ||||||||||||||||||||||||||||||||
| Inj. Vol.: | 2 µL | ||||||||||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||||||||||
| A: | Water, 2 mM ammonium formate, 0.1% formic acid | ||||||||||||||||||||||||||||||||
| B: | Methanol, 2 mM ammonium formate, 0.1% formic acid | ||||||||||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI+/ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
| Sample Preparation | Gummies were manually chopped into small pieces, and 1 g of sample was weighed in a 50 mL polypropylene tube. The sample was mixed with 5 mL of water and then vigorously vortexed until all gummy pieces were fully solubilized. The sample was fortified with pesticides and mycotoxins at 100 ng/g. A mix of internal standards was added at 200 ng/g. The spiked sample was further vortexed for 30 sec. 5 mL of acetonitrile acidified with 1% acetic acid was added to the sample, and this was followed by a 30 sec vortex agitation. Then, a pouch of European EN 15662 QuEChERS extraction salts (cat.# 25849) was added to the sample. The sample was vortexed for 30 sec and then centrifuged for 5 min. 750 µL of organic extract was mixed with 250 µL of water. 2 μL of final extract was injected into the LC-MS/MS system. |
| Notes | Want even better performance when analyzing metal-sensitive compounds? Check out Inert LC columns at www.restek.com/inert. |
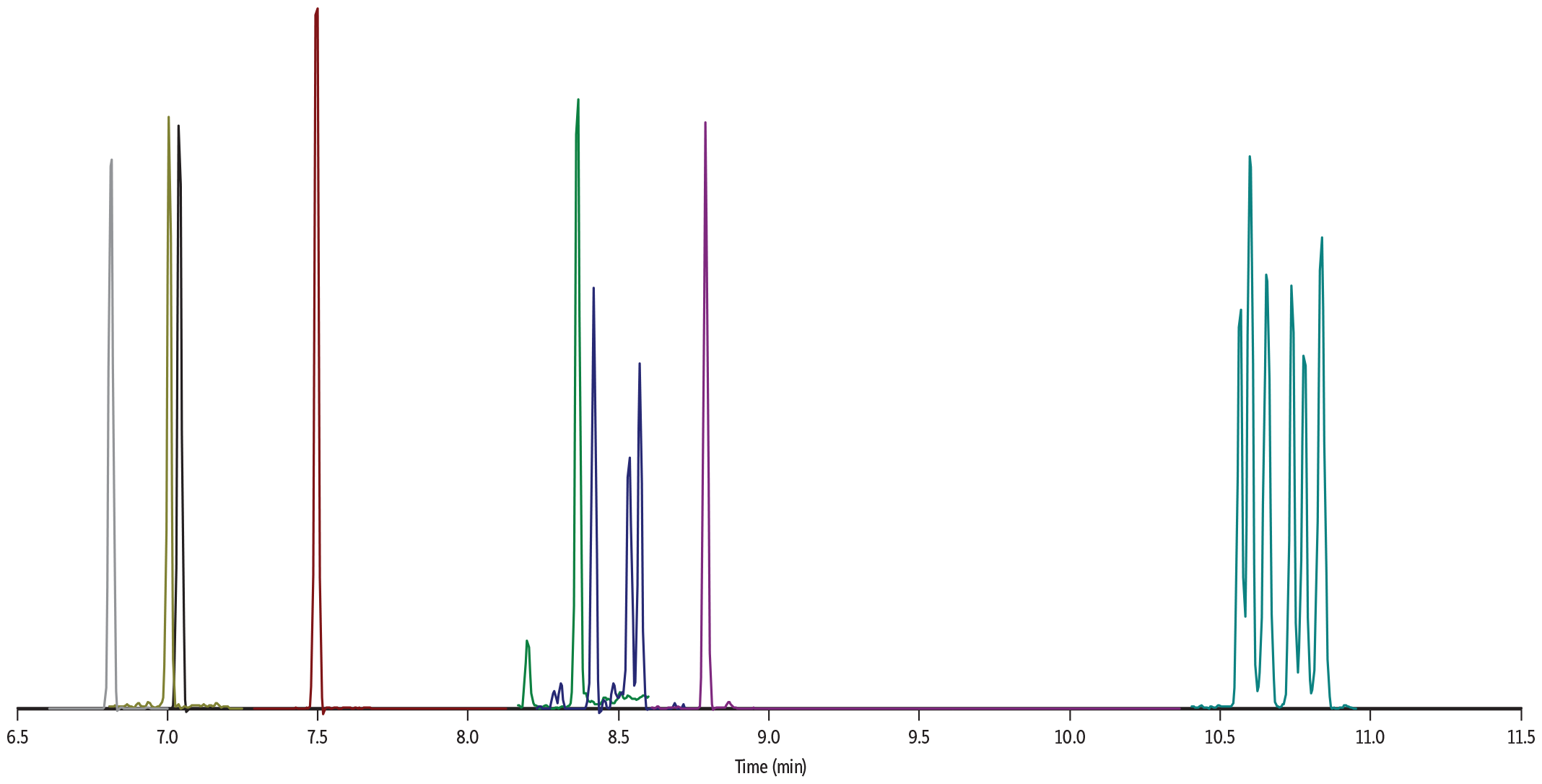
GC_GN1207
Peaks
| Peaks | tR (min) | Polarity | Precursor Ion | Product Ion | Transition Type | |
|---|---|---|---|---|---|---|
| 1. | Atrazine-d5 | 6.82 | Positive | 220.0 | 58.0 | Quantifier |
| 2. | Atrazine-d5 | 6.82 | Positive | 205.0 | 127.0 | Qualifier |
| 3. | Diazinon-d10 (diethyl-d10) | 7.01 | Positive | 183.0 | 139.0 | Quantifier |
| 4. | Diazinon-d10 (diethyl-d10) | 7.01 | Positive | 183.0 | 168.0 | Qualifier |
| 5. | Quintozene | 7.03 | Positive | 294.9 | 236.9 | Quantifier |
| 6. | Quintozene | 7.03 | Positive | 236.8 | 118.9 | Qualifier |
| 7. | Methyl parathion | 7.50 | Positive | 263.0 | 109.0 | Quantifier |
| 8. | Methyl parathion | 7.50 | Positive | 263.0 | 79.0 | Qualifier |
| 9. | Captan | 8.37 | Positive | 184.0 | 149.1 | Quantifier |
| 10. | Captan | 8.37 | Positive | 184.0 | 134.1 | Qualifier |
| 11. | trans-Chlordane | 8.41 | Positive | 271.9 | 237.0 | Quantifier |
| 12. | trans-Chlordane | 8.41 | Positive | 372.9 | 265.9 | Qualifier |
| 13. | cis-Chlordane | 8.53 | Positive | 372.9 | 265.9 | Quantifier |
| 14. | cis-Chlordane | 8.53 | Positive | 271.9 | 237.0 | Qualifier |
| 15. | Chlorfenapyr | 8.80 | Positive | 247.1 | 227.1 | Quantifier |
| 16. | Chlorfenapyr | 8.80 | Positive | 59.1 | 31.1 | Qualifier |
| 17. | Cyfluthrin | 10.61 | Positive | 226.0 | 206.0 | Quantifier |
| 18. | Cyfluthrin | 10.61 | Positive | 163.0 | 127.0 | Qualifier |
| 19. | Cypermethrin | 10.87 | Positive | 163.0 | 127.1 | Quantifier |
| 20. | Cypermethrin | 10.87 | Positive | 181.1 | 152.1 | Qualifier |
Conditions
| Column | Rxi-5ms, 30 m, 0.25 mm ID, 0.25 µm (cat.# 13423) |
|---|---|
| Standard/Sample | |
| California pesticide standard #1 (cat.# 34124) | |
| California pesticide standard #2 (cat.# 34125) | |
| California pesticide standard #3 (cat.# 34126) | |
| California pesticide standard #4 (cat.# 34127) | |
| California pesticide standard #5 (cat.# 34128) | |
| California pesticide standard #6 (cat.# 34129) | |
| Atrazine-d5 (cat.# 31984) | |
| Diazinon-d10 (cat.# 31986) | |
| Diluent: | Acetonitrile |
| Conc.: | 2.5-10 ng/mL Expected concentration range in extract after extracting from gummy fortified at 100 ng/g (final extract was diluted in half with acetonitrile). |
| Injection | |
| Inj. Vol.: | 1 µL splitless |
| Liner: | Topaz 4.0 mm ID single taper inlet liner w/wool (cat.# 23447) |
| Inj. Temp.: | 250 °C |
| Purge Flow: | 5 mL/min |
| Oven | |
| Oven Temp.: | 90 °C (hold 1 min) to 310 °C at 25 °C/min (hold 10 min) |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1.4 mL/min |
| Detector | MS/MS |
|---|---|
| Transfer Line Temp.: | 290 °C |
| Analyzer Type: | Quadrupole |
| Source Temp.: | 330 °C |
| Electron Energy: | 70 eV |
| Tune Type: | PFTBA |
| Ionization Mode: | EI |
| Instrument | Thermo Scientific TSQ 8000 Triple Quadrupole GC-MS |
| Sample Preparation | Gummies were manually chopped into small pieces, and 1 g of sample was weighed in a 50 mL polypropylene tube. The sample was mixed with 5 mL of water and then vigorously vortexed until all gummy pieces were fully solubilized. The sample was fortified with pesticides and mycotoxins at 100 ng/g. A mix of internal standards was added at 200 ng/g. The spiked sample was further vortexed for 30 sec. 5 mL of acetonitrile acidified with 1% acetic acid was added to the sample, and this was followed by 30 sec vortex agitation. Then, a pouch of European EN 15662 QuEChERS extraction salts (cat.# 25849) was added to the sample. The sample was vortexed for 30 sec and then centrifuged for 5 min. 1.9 mL of supernatant was transferred to a Q-sep QuEChERS dSPE tube containing pre-weighed magnesium sulfate, PSA, and GCB (cat.# 26217). After vortexing and centrifuging, 500 μL of extract was mixed with 500 μL of acidified acetonitrile. 1 μL of final extract was injected into the GC-MS/MS system. |
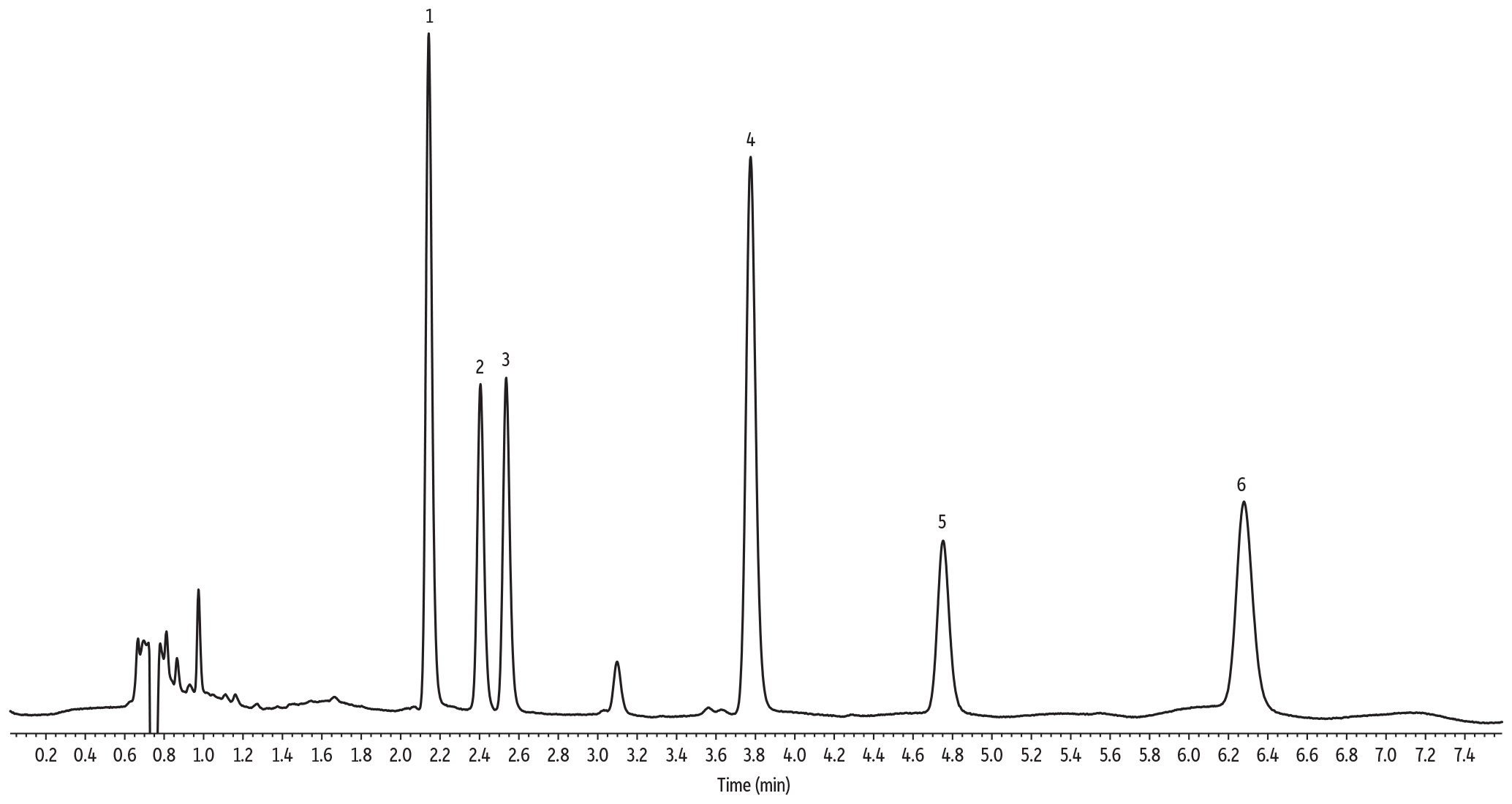
LC_GN0667
Peaks
| Peaks | tR (min) | mg/g* | |
|---|---|---|---|
| 1. | Cannabidiolic acid (CBDA) | 2.142 | 0.2 |
| 2. | Cannabigerol (CBG) | 2.405 | 0.2 |
| 3. | Cannabidiol (CBD) | 2.535 | 0.2 |
| 4. | Cannabinol (CBN) | 3.776 | 0.2 |
| 5. | Δ9-Tetrahydrocannabinol (Δ9-THC) | 4.753 | 0.2 |
| 6. | Tetrahydrocannabinolic acid A (THCA-A) | 6.279 | 0.2 |
Conditions
| Column | Raptor ARC-18 (cat.# 9314A62) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 150 mm x 2.1 mm ID | ||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||
| Pore Size: | 90 Å | ||||||||||||
| Guard Column: | Raptor ARC-18 EXP guard column cartridge 5 mm, 2.1 mm ID, 2.7 µm (cat.# 9314A0252) | ||||||||||||
| Temp.: | 30 °C | ||||||||||||
| Standard/Sample | |||||||||||||
| Cannabinoids standard (cat.# 34014) | |||||||||||||
| Cannabigerol (cat.# 34091) | |||||||||||||
| d9-Tetrahydrocannabinol (cat.# 34067) | |||||||||||||
| d9-Tetrahydrocannabinolic acid A (cat.# 34111) | |||||||||||||
| Diluent: | 75:25 Acetonitrile:water | ||||||||||||
| Conc.: | Expected concentration of 4 ppm in final extract from gummy initially spiked at 0.2 mg/g. | ||||||||||||
| Inj. Vol.: | 2 µL | ||||||||||||
| Mobile Phase | |||||||||||||
| A: | Water, 5 mM ammonium formate, 0.1% formic acid | ||||||||||||
| B: | Acetonitrile, 0.1% formic acid | ||||||||||||
|
| Detector | UV/Vis @ 228 nm |
|---|---|
| Instrument | UHPLC |
| Sample Preparation | Gummies were manually chopped into small pieces, and 1 g of sample was weighed in a 50 mL polypropylene tube. The sample was mixed with 5 mL of water and then vigorously vortexed until all gummy pieces were fully solubilized. The sample was fortified with cannabinoids at 0.2 mg/g. The spiked sample was further vortexed for 30 sec. 5 mL of acetonitrile acidified with 1% acetic acid was added to the sample, and this was followed by 30 sec vortex agitation. Then, a pouch of European EN 15662 QuEChERS extraction salts (cat.# 25849) was added to the sample. The sample was vortexed for 30 sec and then centrifuged for 5 min. 100 µL of organic extract was mixed with 900 µL of 75:25 acetonitrile:water. 2 µL of final extract was injected into the HPLC-UV system. |
Conclusion
Une méthode simple et efficace pour l’analyse des pesticides, des mycotoxines et des cannabinoïdes dans les bonbons gélifiés au cannabis a été développé. Les conditions de préparation d’échantillons ont inclus l’homogénéisation de la matrice (bonbons gélifiés en petits morceaux) avec de l’eau, l’extraction des analytes à l’aide d’acétonitrile acidifié suivie d’une étape de relargage à l’aide de sels d’extraction QuEChERS Q-sep ; la dilution de l’extrait (pour les contaminants et les cannabinoïdes susceptibles d’être analysés par LC-MS/MS) ; et le nettoyage/la purification dSPE à l’aide de sulfate de magnésium, de PSA et de GCB (pour les pesticides analysables par GC-MS/MS). Des résultats satisfaisants en termes de LQ, de linéarité, d’exactitude et de précision ont été obtenus pour tous les contaminants cibles. De plus, nos données ont démontré que la méthodologie proposée convient aux analyses de puissance avec des valeurs d’exactitude comprises entre 99 et 107 % pour les six cannabinoïdes répertoriés dans la réglementation sur le cannabis de l’État de Californie. Dans l’ensemble, la méthode présentée simplifie le travail des laboratoires d’analyse de cannabis en permettant la quantification de plusieurs familles de composés dans des échantillons de bonbons gélifiés à l’aide d’un seul et unique extrait.
Références
- Text of Regulations, Bureau of Cannabis Control, California Code of Regulations, https://cannabis.ca.gov/wp-content/uploads/sites/13/2019/01/Order-of-Adoption-Clean-Version-of-Text.pdf, (accessed 8 November 2019).
- X. Wang, D. Mackowsky, J. Searfoss, M. J. Telepchak, Determination of cannabinoid content and pesticide residues in cannabis edibles and beverages, Cannabis Sci. and Tech. (2018). https://www.cannabissciencetech.com/view/determination-cannabinoid-content-and-pesticide-residues-cannabis-edibles-and-beverages.
- Fast, low-solvent analysis of cannabinoids increases lab productivity and decreases solvent costs, Restek Corporation.
- N. Reyes-Garces, C. Myers, Analysis of pesticides and mycotoxins cannabis brownies, Restek Corporation.
- B. K. Matuszewski, M. L. Constanzer, C. M. Chavez-Eng, Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC−MS/MS, Anal. Chem. 75 (2003) 3019–3030. https://pubs.acs.org/doi/10.1021/ac020361s





