Abstract
Lo stato della California richiede l’analisi di pesticidi, micotossine e cannabinoidi in tutti i tipi di prodotti derivati dalla cannabis [1]. Per questo motivo è fondamentale sviluppare flussi di lavoro affidabili che consentano di determinare facilmente tali analiti in diverse matrici. Le caramelle gommose alla cannabis sono un prodotto alimentare molto diffuso, la cui composizione le rende una matrice altamente complessa. In questo studio illustreremo un flusso di lavoro completo, che utilizza un’unica procedura di estrazione, per l’analisi nelle caramelle gommose dei pesticidi, delle micotossine e dei cannabinoidi indicati dal governo californiano.
Introduzione
I prodotti alimentari arricchiti di cannabis o cannabidiolo (CBD) sono sempre più diffusi fra i consumatori di cannabis. In ambito analitico, è obbligatorio eseguire analisi di potenza dei prodotti alimentari in tutti gli Stati che richiedono per legge le analisi di laboratorio. Inoltre, lo stato della California prevede anche la determinazione di contaminanti, come pesticidi e micotossine, negli alimenti e in altri tipi di prodotti derivati dalla cannabis. Data l’ampia varietà di prodotti alimentari disponibili in commercio, per ottenere dati affidabili per tutti gli analiti di interesse e in qualsiasi tipo di matrice è necessario adottare strategie analitiche differenti. Fra i vari tipi di prodotti alimentari a base di cannabis, le caramelle gommose rappresentano una grande sfida per i laboratori di analisi;
si tratta di una matrice “appiccicosa” composta in genere da zucchero, amido, pectina e gelatina. Data la composizione del campione, le strategie di preparazione per l’analisi di potenza solitamente prevedono una fase di solubilizzazione in solventi come acqua o DMSO, oppure, in alternativa, si possono utilizzare grandi volumi di solventi come il metanolo. Una volta omogenizzato il campione, i cannabinoidi vengono quantificati tramite HPLC-UV iniettando l’estratto diluito direttamente oppure dopo una fase di salting-out eseguita con i sali QuEChERS. Esistono poche informazioni di dominio pubblico relative all’analisi di contaminanti come pesticidi e micotossine in matrici di caramelle gommose; è infatti disponibile un solo report che illustra i dati semi-quantitativi di 35 pesticidi utilizzando i QuEChERS [2].
In questo studio delineiamo un flusso di lavoro affidabile per la determinazione quantitativa nei campioni di caramelle gommose di pesticidi, micotossine e cannabinoidi presenti nell’elenco stilato dal governo californiano. La metodologia ottimizzata di preparazione prevede la solubilizzazione del campione, seguita da una fase di estrazione con acetonitrile acidificato e un passaggio di salting-out per il quale si utilizzano i sali QuEChERS per EN. Per l’analisi di cannabinoidi e contaminanti compatibili con la LC è stata condotta una diluizione semplice prima dell’iniezione, mentre per i pesticidi analizzabili in GC, prima dell’analisi, è stato necessario utilizzare una miscela di sorbente dSPE contenente ammine primarie/secondarie (PSA), nero di carbonio grafitato (GCB) e solfato di magnesio. Nel complesso, il flusso di lavoro proposto per l’analisi di pesticidi, micotossine e cannabinoidi nelle caramelle gommose alla cannabis ha fornito risultati soddisfacenti in termini di linearità, accuratezza, precisione e limiti di quantificazione (LOQ).
Studio sperimentale
Preparazione del campione
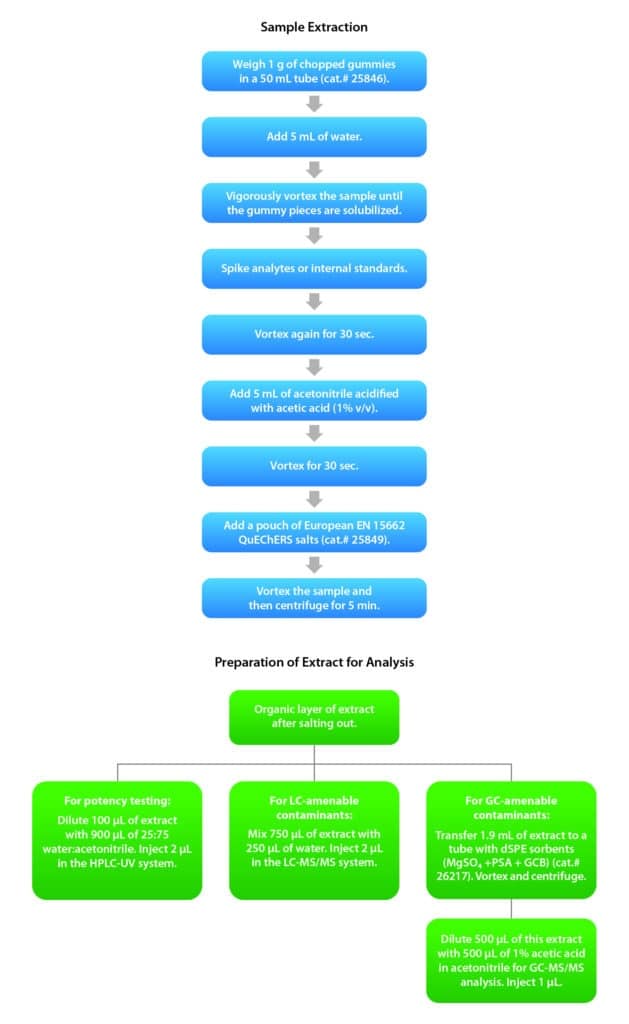
A valle dei test preliminari sui vari parametri sperimentali è stato implementato il seguente flusso di lavoro (Figura 1). È stato pesato 1 g di caramelle tritate in una provetta da 50 mL (cat.# 25846) e sono stati aggiunti 5 mL di acqua. I campioni sono stati poi vortexati con forza finché i pezzi di caramella si sono solubilizzati. La soluzione del campione è stata poi adeguatamente fortificata con analiti target e/o standard interni (gli standard interni sono stati utilizzati solo per l’analisi dei contaminanti e non per l’analisi di potenza). Dopodiché il tutto è stato vortexato per ulteriori 30 secondi. A seguire, sono stati aggiunti 5 mL di acetonitrile acidificato con acido acetico (1% v:v) e i campioni sono stati nuovamente vortexati per 30 secondi. È stato aggiunto un pacchetto di sali di estrazione Q-sep QuEChERS per la norma europea EN 15662 (cat.# 25849), poi il campione è stato passato nuovamente al vortex e centrifugato per 5 minuti.
Per l’analisi di potenza sono stati miscelati 100 µL di estratto del campione e 900 µL di 25:75 acqua:acetonitrile, mentre 2 µL sono stati analizzati in LC-UV. Per quanto riguarda i contaminanti compatibili con la LC, sono stati miscelati 750 µL di estratto del campione e 250 µL di acqua, mentre 2 μL sono stati analizzati in LC-MS/MS. Sul fronte invece dei contaminanti analizzabili in GC, sono stati trasferiti 1,9 mL di estratto in una provetta dSPE Q-sep QuEChERS contenente sorbenti pre-pesati di PSA, GCB e solfato di magnesio (cat.# 26217). Dopo il passaggio al vortex e la centrifuga sono stati miscelati 500 μL di estratto con 500 μL di 1% di acido acetico in acetonitrile, mentre 1 μL è stato analizzato in GC-MS/MS.
Quantificazione
Ai fini delle analisi di pesticidi e micotossine, le soluzioni di calibrazione sono state preparate fortificando con analiti e standard interni le aliquote dell’estratto ottenuto da campioni bianchi di caramelle gommose (è stato ottenuto un estratto misto miscelando gli estratti di vari campioni bianchi di caramelle gommose). La Tabella I mostra il volume della soluzione di spiking con analiti target e della soluzione della miscela di standard interni aggiunto a ciascuna aliquota (volume della soluzione di calibrazione finale = 3 mL). Per costruire le curve di calibrazione dei pesticidi analizzabili in GC, 1,9 mL dei 3 mL delle soluzioni di calibrazione sono stati sottoposti a purificazione dSPE, come descritto nella sezione dedicata alla preparazione del campione. L’accuratezza e la precisione del metodo sono state valutate fortificando in quadruplicato le caramelle gommose omogeneizzate a 10, 50, 100 e 500 ng/g, dopo l’aggiunta di acqua e il passaggio al vortex (Tabella II), e seguendo tutto il flusso di lavoro di preparazione del campione descritto nella sezione dedicata.
Per l’analisi dei cannabinoidi sono state preparate soluzioni di calibrazione a 2, 5, 10, 20, 50, 100 e 200 ppm in 75:25 acetonitrile:acqua. È stato valutato il recupero dei cannabinoidi fortificando campioni di 1 g di caramelle gommose solubilizzate in acqua a 0,2 e 0,5 mg/g (n=2), procedendo poi all’estrazione come descritto sopra.
Tabella I: Preparazione dei calibratori per l’analisi di pesticidi e micotossine con l’utilizzo di aliquote di estratti ottenuti da campioni bianchi di caramelle gommose (volume finale di ciascuna soluzione di calibrazione = 3 mL).
| Analiti desiderati Conc. nella matrice (ng/g) | Conc. dell’analita nell’estratto finale ipotizzando un recupero del 100% dalla matrice (ng/mL) | µL di soluzione di analiti target addizionati nell’estratto bianco | Conc. dell’analita nella soluzione di spiking (ng/mL) | µL di 5000 ng/mL di miscela di standard interno aggiunti all’estratto bianco |
| 5 | 1 | 30 | 100 | 24 |
| 20 | 4 | 12 | 1000 | 24 |
| 50 | 10 | 30 | 1000 | 24 |
| 75 | 15 | 45 | 1000 | 24 |
| 150 | 30 | 90 | 1000 | 24 |
| 200 | 40 | 24 | 5000 | 24 |
| 400 | 80 | 48 | 5000 | 24 |
| 700 | 140 | 84 | 5000 | 24 |
Tabella II: Fortificazione di micotossine e pesticidi nelle caramelle gommose (1 g di campione omogeneizzato con 5 mL di acqua) a diversi livelli di concentrazione..
| Conc. nella matrice (ng/g) | µL di soluzione di analiti target addizionati nei campioni omogeneizzati in acqua | Conc. dell’analita nella soluzione di spiking (ng/mL) | µL di 5000 ng/mL di miscela di standard interno aggiunti a campioni omogeneizzati in acqua |
| 10 | 10 | 1000 | 40 |
| 50 | 50 | 1000 | 40 |
| 100 | 100 | 1000 | 40 |
| 500 | 100 | 5000 | 40 |
Parametri dello strumento
La strumentazione e le condizioni per l’analisi di pesticidi, micotossine e cannabinoidi nelle caramelle di cannabis sono presentate nelle tabelle III, IV e V. Le transizioni ioniche per i contaminanti ammessi alla LC e alla GC sono presentate rispettivamente nelle tabelle VI e VII. I tempi di ritenzione dei cannabinoidi sono riportati nella Tabella VIII.
Tabella III: Condizioni LC-MS/MS (pesticidi e micotossine).
| Colonna | Raptor ARC-18 2.7 µm, 100 mm x 2.1 mm (cat.# 9314A12) | |||
| Precolonna | Cartuccia per precolonna Raptor ARC-18 EXP 2,7 µm, 5 x 2,1 mm (cat.# 9314A0252) | |||
| Fase mobile A | Acqua, formato di ammonio 2 mM, acido formico 0,1% | |||
| Fase mobile B | Metanolo, formato di ammonio 2 mM, acido formico 0,1% | |||
| Scansione temporale | Tempo (min.) | %B | Tempo (min.) | %B |
| 0 | 5 | 10.5 | 100 | |
| 1.5 | 65 | 10.6 | 5 | |
| 8.5 | 95 | 12.0 | 5 | |
| 9.5 | 100 | – | – | |
| Flusso | 0.5 mL/min | |||
| Temp. colonna | 40 °C | |||
| Temp. autocampionatore | 10 °C | |||
| Volume di iniezione | 2 μL | |||
| Strumento | Shimadzu LCMS-8060 | |||
Tabella IV: Condizioni GC-MS/MS (pesticidi).
| Strumento | Thermo Trace 1310-TSQ 8000 |
| Colonna: | Rxi-5ms, 30 m x 0.25 mm ID x 0.25 µm, (cat.# 13423) |
| Modalità di iniezione | Splitless |
| Vol. iniezione | 1 µL |
| Liner | Topaz a cono singolo con ID 4,0 mm con lana (cat.# 23447) |
| Temp. iniez. | 250 °C |
| Flusso split | 14.0 mL/min |
| Tempo splitless | 0.50 min |
| Flusso di spurgo | 5 mL/min |
| Forno | 90 °C (mantenimento 1 min.) fino a 310 °C a 25 °C/min (mantenimento 10 min.) |
| Carrier Gas | He, flusso costante |
| Velocità flusso | 1.40 mL/min |
| Detector | MS/MS |
| Tipo di metodo | Acquisizione – a tempo |
| Modalità di ionizzazione | EI |
| Temp. linea di trasferimento | 290 °C |
| Temp. sorgente | 330 °C |
Tabella V: Condizioni HPLC-UV (analisi di potenza con un metodo a risparmio di solvente [3]).
| Strumento | Waters ACQUITY |
| Colonna: | Raptor ARC-18 2.7 µm, 150 mm x 2.1 mm (cat.# 9314A62) |
| Precolonna | Cartuccia per precolonna Raptor ARC-18 EXP 2,7 µm, 5 x 2,1 mm (cat.# 9314A0252) |
| Vol. iniezione | 2 µL |
| Fase mobile A | Acqua, formato di ammonio 5 mM, acido formico 0,1% |
| Fase mobile B | Acetonitrile, acido formico 0,1% |
| Gradiente | Isocratico, 75% B |
| Flusso | 0.4 mL/min |
| Temp. Colonna | 30 °C |
| Autosampler Temp. | 10 °C |
| Lunghezza d’onda | 228 nm |
Tabella VI: Transizioni LC-MS/MS
| Nome | Tempo di ritenzione (min.) | Ione precursore | Ione prodotto 1 | Product Ion 2 |
| Daminozide-D6 | 0.7 | 167.0 | 149.3 | 49.3 |
| Daminozide | 0.7 | 161.1 | 44.1 | 143.2 |
| Acephate | 1.7 | 184.0 | 143.1 | 95.1 |
| Oxamyl | 2.0 | 237.1 | 72.1 | 90.1 |
| Flonicamid | 2.1 | 230.1 | 203.1 | 174.1 |
| Methomyl | 2.1 | 163.1 | 88.1 | 106.1 |
| Thiamethoxam | 2.1 | 292.0 | 211.1 | 181.1 |
| Imidacloprid | 2.3 | 256.1 | 209.1 | 175.1 |
| Mevinphos | 2.4 | 225.1 | 127.1 | 193.2 |
| Acetamiprid | 2.4 | 223.0 | 126.1 | 56.1 |
| Dimethoathe-D6 | 2.4 | 236.1 | 205.1 | – |
| Dimethoate | 2.4 | 230.0 | 199.1 | 125.1 |
| Thiacloprid | 2.5 | 253.0 | 126.0 | 90.1 |
| Aflatoxin G2 | 2.5 | 331.2 | 189.3 | 115.2 |
| Aflatoxin G1 | 2.5 | 329.2 | 243.2 | 215.3 |
| Aldicarb | 2.6 | 116.0 | 89.2 | 70.2 |
| Aflatoxin B2 | 2.6 | 315.3 | 287.2 | 243.3 |
| Dichlorvos | 2.7 | 220.9 | 109.1 | 79.2 |
| Dichlorvos-D6 | 2.7 | 227.0 | 115.1 | – |
| Aflatoxin B1 | 2.7 | 313.2 | 241.2 | 128.2 |
| Imazalil | 2.7 | 297.0 | 159.0 | 201.0 |
| Carbofuran | 2.7 | 222.1 | 123.1 | 165.2 |
| Propoxur | 2.7 | 210.1 | 111.1 | 93.1 |
| Carbaryl-D7 | 2.8 | 209.2 | 152.2 | – |
| Carbaryl | 2.8 | 202.1 | 145.1 | 127.1 |
| Diuron-D6 | 3.0 | 239.1 | 78.2 | – |
| Atrazine-D5 | 3.0 | 221.2 | 179.1 | – |
| Naled | 3.1 | 397.8 | 127.1 | 109.1 |
| Metalaxyl | 3.1 | 280.2 | 220.2 | 192.2 |
| Spiroxamine | 3.1 | 298.3 | 144.2 | 100.2 |
| Chlorantraniliprole | 3.2 | 483.9 | 452.9 | 285.9 |
| Phosmet | 3.2 | 318.0 | 160.1 | 77.2 |
| Azoxystrobin | 3.3 | 404.0 | 372.1 | 344.1 |
| Linuron-D6 | 3.3 | 255.1 | 160.1 | – |
| Fludioxonil* | 3.4 | 247.0 | 180.0 | 126.0 |
| Methiocarb | 3.4 | 226.1 | 169.1 | 121.1 |
| Dimethomorph | 3.5 | 388.2 | 301.2 | 165.3 |
| Boscalid | 3.5 | 342.9 | 307.1 | 140.1 |
| Paclobutrazol | 3.6 | 294.3 | 70.1 | 125.1 |
| Malathion | 3.6 | 331.0 | 127.2 | 285.2 |
| Myclobutanil | 3.7 | 289.1 | 70.1 | 125.1 |
| Bifenazate | 3.7 | 301.0 | 198.1 | 170.2 |
| Ochratoxin A | 3.8 | 404.2 | 239.1 | 358.3 |
| Fenhexamid | 3.9 | 302.1 | 97.1 | 55.2 |
| Spirotetramat | 4.0 | 374.2 | 302.1 | 216.1 |
| Ethoprophos | 4.1 | 243.1 | 131.1 | 97.1 |
| Fipronil* | 4.1 | 436.8 | 331.8 | 251.9 |
| Fenoxycarb | 4.2 | 302.1 | 88.1 | 116.1 |
| Kresoxim methyl | 4.4 | 314.2 | 267.2 | 222.2 |
| Tebuconazole | 4.4 | 308.1 | 70.1 | 125.1 |
| Diazinon-D10 | 4.6 | 315.2 | 170.2 | – |
| Spinosad (spinosyn A) | 4.6 | 732.4 | 142.2 | 98.1 |
| Diazinon | 4.6 | 305.1 | 169.2 | 153.2 |
| Coumaphos | 4.7 | 363.1 | 227.1 | 307.1 |
| Pyridaben | 4.7 | 365.1 | 309.2 | 147.2 |
| Propiconazole | 4.7 | 342.0 | 159.0 | 69.2 |
| Clofentezine | 4.8 | 303.0 | 138.1 | 102.1 |
| Spinosad (spinosyn D) | 5.0 | 746.5 | 142.3 | 98.4 |
| Spinetoram (spinosyn J) | 5.1 | 748.5 | 142.3 | 98.3 |
| Trifloxystrobin | 5.3 | 409.2 | 186.1 | 145.1 |
| Prallethrin | 5.3 | 301.2 | 123.2 | 105.2 |
| Pyrethrin II | 5.5 | 373.1 | 161.1 | 133.2 |
| Spinetoram (spinosyn L) | 5.6 | 760.5 | 142.2 | 98.1 |
| Piperonyl butoxide | 6.0 | 356.3 | 177.2 | 119.2 |
| Chlorpyrifos | 6.1 | 349.9 | 198.0 | 97.1 |
| Hexythiazox | 6.2 | 353.1 | 228.1 | 168.1 |
| Etoxazole | 6.6 | 360.2 | 141.1 | 304.2 |
| Spiromesifen | 6.7 | 273.2 | 255.2 | 187.2 |
| Pyrethrin I | 6.9 | 329.2 | 161.2 | 105.2 |
| Cyfluthrin (qualifier) | 6.9 | 453.1 | 193.2 | – |
| Cyfluthrin | 6.9 | 451.1 | 191.2 | – |
| Cypermethrin | 7.1 | 433.1 | 191.0 | 416.0 |
| (E)-Fenpyroximate | 7.1 | 422.2 | 366.1 | 138.1 |
| Permethrin-trans | 7.6 | 408.3 | 183.2 | 355.1 |
| Permethrin-cis | 7.9 | 408.3 | 183.2 | 355.1 |
| Avermectin B1a | 7.9 | 890.5 | 305.4 | 567.4 |
| Etofenprox | 8.0 | 394.3 | 177.2 | 359.3 |
| Bifenthrin | 8.2 | 440.0 | 181.2 | 166.2 |
| Acequinocyl precursor ion 1 | 9.4 | 402.3 | 343.2 | 189.0 |
| Acequinocyl precursor ion 2 | 9.4 | 386.0 | 344.2 | 189.1 |
* Analizzati in modalità negativa.
Tabella VII: Transizioni GC-MS/MS.
| Nome | Tempo di ritenzione (min.) | Polarità ionica | Ione precursore | Ione prodotto |
| Atrazine-D5 (IS) (Quan) | 6.82 | Positive | 220.0 | 58.0 |
| Atrazine-D5 (IS) (Qual) | 6.82 | Positive | 205.0 | 127.0 |
| Diazinon-D10 (Quan) | 7.01 | Positive | 183.0 | 139.0 |
| Diazinon-D10 (Qual) | 7.01 | Positive | 183.0 | 168.0 |
| Quintozene (PCNB) (Quan) | 7.03 | Positive | 294.9 | 236.9 |
| Quintozene (PCNB) (Qual) | 7.03 | Positive | 236.8 | 118.9 |
| Methyl parathion (Quan) | 7.50 | Positive | 263.0 | 109.0 |
| Methyl parathion (Qual) | 7.50 | Positive | 263.0 | 79.0 |
| Captan (Quan) | 8.37 | Positive | 184.0 | 149.1 |
| Captan (Qual) | 8.37 | Positive | 184.0 | 134.1 |
| trans-Chlordane (Quan) | 8.41 | Positive | 271.9 | 237.0 |
| trans-Chlordane (Qual) | 8.41 | Positive | 372.9 | 265.9 |
| cis-Chlordane (Quan) | 8.53 | Positive | 372.9 | 265.9 |
| cis-Chlordane (Qual) | 8.53 | Positive | 271.9 | 237.0 |
| Chlorfenapyr (Quan) | 8.80 | Positive | 247.1 | 227.1 |
| Chlorfenapyr (Qual) | 8.80 | Positive | 59.1 | 31.1 |
| Cyfluthrin (Quan) | 10.61 | Positive | 226.0 | 206.0 |
| Cyfluthrin (Qual) | 10.61 | Positive | 163.0 | 127.0 |
| Cypermethrin (Quan) | 10.87 | Positive | 163.0 | 127.1 |
| Cypermethrin (Qual) | 10.87 | Positive | 181.1 | 152.1 |
Tabella VIII: Tempi di ritenzione dei cannabinoidi..
| Composto | Tempo di ritenzione (min.) |
| Cannabidiolic acid (CBDA) | 2.142 |
| Cannabigerol (CBG) | 2.405 |
| Cannabidiol (CBD) | 2.535 |
| Cannabinol (CBN) | 3.776 |
| Delta-9-tetrahydrocannabinol (Delta-9-THC) | 4.753 |
| Tetrahydrocannabinolic acid (THCA) | 6.279 |
Risultati e discussione
Ottimizzazione del metodo
La varietà delle matrici di cannabis e le caratteristiche chimiche differenti degli analiti target impongono l’adozione di strategie diversificate per ottenere risultati accurati. L’analisi di pesticidi, micotossine e cannabinoidi nelle caramelle gommose alla cannabis, come previsto dallo stato della California, richiede condizioni sperimentali totalmente diverse rispetto a quelle adottate per i brownie nel nostro precedente articolo tecnico [4]. Innanzitutto, abbiamo constatato che trattare le caramelle gommose polverizzate (tritate con ghiaccio secco e un robot da cucina) può sollevare problematiche complesse perché la matrice, una volta a temperatura ambiente, diventa molto appiccicosa. Per questo motivo si è rivelata un’alternativa decisamente migliore tagliare le caramelle gommose in piccoli pezzi, in modo da riuscire a manipolarle più facilmente quando si pesano le quantità necessarie di campione.
La sfida successiva è stata quella di individuare l’approccio migliore per dissolvere la matrice prima dell’estrazione e ottenere così risultati affidabili. Poiché il campione è stato tritato in piccoli pezzi di dimensione casuale, avere una matrice omogenea è stato fondamentale per garantire una riproducibilità del metodo soddisfacente. In primo luogo, abbiamo valutato l’utilizzo di solventi come acetonitrile e metanolo per dissolvere i pezzi delle caramelle gommose ed estrarre gli analiti di interesse tramite una semplice estrazione di solvente. Tuttavia, abbiamo riscontrato grandi difficoltà nel solubilizzare la matrice in queste condizioni, quindi abbiamo valutato anche l’utilizzo di DMSO. Nonostante tutti i pezzi di caramelle gommose siano stati dissolti facilmente in questo solvente, il daminozide non è stato rilevato in nessuno degli estratti perché la piccola percentuale di DMSO rimasta nei campioni iniettati ha portato alla soppressione della ionizzazione. Dopo questi test, abbiamo concluso che il modo migliore per ottenere un campione omogeneo fosse idratare il campione con 5 mL di acqua e poi effettuare un vigoroso passaggio al vortex. Dopodiché, per estrarre tutti i contaminanti dalla matrice sono stati aggiunti al campione dissolto 5 mL di acetonitrile acidificato a 1% con acido acetico.
Ai fini della separazione dello strato organico da quello acquoso sono stati confrontati tre differenti sali di estrazione Q-sep QuEChERS: AOAC (cat.# 25851), senza tampone (cat.# 25847) ed EN (cat.# 25849). I sali EN hanno ottenuto le prestazioni migliori, mostrando recuperi superiori all’83% per tutti i composti a esclusione del daminozide e del suo analogo deuterato, che invece hanno raggiunto un recupero del 25%. Per quanto riguarda la fase di purificazione, è stato valutato l’effetto di quattro diverse miscele di sorbenti dSPE Q-sep QuEChERS (cat.# 26215, 26216, 26217, 26242) in tutti i pesticidi analizzabili in LC-MS. È stato confermato che tutte le miscele contenenti 25 mg di PSA (cat.# 26215, 26216, 26217) hanno provocato perdite significative di daminozide e di ocratossina A, con un recupero pari solo al 40% del quantitativo iniziale presente nella soluzione. La miscela dSPE contenente MgSO4 e C18 (cat.# 26242) non ha causato perdite significative di pesticidi, ma abbiamo deciso di valutare l’idoneità, per la quantificazione di analiti compatibili con la LC, dell’utilizzo dell’estratto organico senza alcuna ulteriore fase di purificazione.
Per valutare la fattibilità di un’analisi diretta degli estratti sono stati condotti esperimenti volti a studiare gli effetti assoluti della matrice negli estratti di caramelle senza alcuna fase di purificazione, utilizzando la metodologia proposta da Matuszweski et al. [5]. Gli estratti ottenuti dai campioni bianchi sono stati fortificati alle concentrazioni finali di 5, 15 e 50 ppb e tramite LC-MS/MS sono state confrontate le loro risposte con quelle del solvente puro, fortificato agli stessi livelli di concentrazione. A 5 ppb, 12 pesticidi hanno mostrato effetti di matrice superiori al 120%, mentre a 15 ppb e 50 ppb solo il daminozide è risultato potenziato in modo significativo (Tabella IX). Considerando questo e lo scarso recupero di daminozide, utilizzare il daminozide-d6 come standard interno è stato fondamentale per riuscire a ottenere dati affidabili.
Per quanto riguarda i recuperi dei pesticidi analizzabili in GC, i dati relativi alla valutazione di tre miscele di sorbenti dSPE (cat.# 26215, 26216, e 26217) hanno mostrato che, mettendo a confronto le risposte dell’estratto purificato e quelle dell’estratto originale, in tutti i casi i recuperi sono stati superiori al 96%. Dato l’alto contenuto di zucchero e pigmenti negli estratti di caramelle gommose, per la procedura finale per la preparazione del campione è stato scelto il sorbente dSPE contenente PSA, GCB e solfato di magnesio (cat.# 26217).
Verifica del metodo
La Tabella X mostra i risultati quanto a limiti di quantificazione, linearità, accuratezza e precisione relativi a pesticidi e micotossine presenti nella lista stilata dal governo della California, determinati nella matrice di caramelle gommose. Per tutti i contaminanti analizzati in LC-MS/MS, le curve di calibrazione sono state tracciate utilizzando i rapporti delle risposte degli analiti e degli standard interni e un fattore di ponderazione di 1/x. In riferimento agli analiti analizzabili in GC, solo la curva di calibrazione del PCNB è stata elaborata con il rapporto analita/standard interno, avendo come standard interno il diazinone-d10. La quantificazione per i restanti composti compatibili con la GC è stata effettuata con curve di calibrazione esterne (area vs. concentrazione fortificata) perché in questo modo si sono ottenuti risultati migliori rispetto al procedimento con gli standard interni. Sono stati ottenuti valori di RSD inferiori al 24% per tutti gli analiti e a tutti i livelli di concentrazione testati. I valori di accuratezza riscontrati sono stati fra il 75 e il 118%, mentre i coefficienti di determinazione (R2) erano tutti superiori a 0,99.
Infine, i risultati delle analisi dei cannabinoidi hanno dimostrato che l’estratto ottenuto per la determinazione dei contaminanti è adatto anche per l’analisi di potenza. La Tabella XI mostra i dati relativi alle curve di calibrazione preparate in solvente per la quantificazione di ciascun cannabinoide. Come illustrato nella Tabella XII, i campioni di caramelle gommose fortificati con sei cannabinoidi a 0,2 mg/g hanno mostrato recuperi fra il 99% e il 107%, mentre i campioni fortificati a 0,5 mg/g hanno avuto recuperi fra il 99% e il 106%; le Figure da 2 a 4 riportano i rispettivi cromatogrammi.
Tabella IX: Effetti assoluti della matrice (ME) per pesticidi e micotossine nelle caramelle gommose alla cannabis.
| ME at 5 ppb (%) | RSD | ME at 15 ppb (%) | RSD | ME at 50 ppb (%) | RSD | |
| Daminozide | 216 | 3 | 251 | 7 | 185 | 3 |
| Acephate | 95 | 6 | 85 | 1 | 89 | 6 |
| Oxamyl | 105 | 5 | 96 | 2 | 98 | 5 |
| Flonicamid | 91 | 32 | 90 | 22 | 97 | 17 |
| Methomyl | 104 | 4 | 92 | 3 | 99 | 4 |
| Thiamethoxam | 105 | 5 | 92 | 5 | 96 | 5 |
| Imidacloprid | 114 | 9 | 87 | 9 | 100 | 9 |
| Mevinphos | 102 | 6 | 93 | 3 | 93 | 6 |
| Acetamiprid | 100 | 2 | 88 | 0 | 91 | 2 |
| Dimethoate | 97 | 3 | 92 | 3 | 93 | 3 |
| Thiacloprid | 109 | 7 | 93 | 1 | 93 | 7 |
| Aflatoxin G2 | 102 | 6 | 86 | 0 | 93 | 6 |
| Aflatoxin G1 | 106 | 7 | 93 | 1 | 91 | 7 |
| Aldicarb | 81 | 22 | 85 | 14 | 90 | 22 |
| Aflatoxin B2 | 113 | 11 | 79 | 9 | 95 | 11 |
| Dichlorvos | 126 | 15 | 90 | 6 | 92 | 15 |
| Aflatoxin B1 | 104 | 9 | 93 | 5 | 95 | 9 |
| Imazalil | 92 | 1 | 96 | 3 | 98 | 1 |
| Carbofuran | 106 | 3 | 98 | 1 | 102 | 3 |
| Propoxur | 104 | 3 | 96 | 4 | 96 | 3 |
| Carbaryl | 103 | 4 | 99 | 8 | 93 | 4 |
| Naled | 101 | 4 | 94 | 2 | 84 | 4 |
| Metalaxyl | 105 | 3 | 97 | 2 | 97 | 3 |
| Spiroxamine | 105 | 4 | 94 | 1 | 97 | 4 |
| Chlorantraniliprole | 114 | 6 | 88 | 5 | 100 | 6 |
| Phosmet | 108 | 10 | 100 | 6 | 92 | 10 |
| Azoxystrobin | 104 | 1 | 94 | 1 | 94 | 1 |
| Fludioxonil | 101 | 7 | 90 | 11 | 94 | 7 |
| Methiocarb | 102 | 5 | 94 | 3 | 95 | 5 |
| Dimethomorph | 108 | 15 | 93 | 0 | 93 | 15 |
| Boscalid | 119 | 11 | 94 | 4 | 85 | 11 |
| Paclobutrazol | 110 | 10 | 90 | 2 | 92 | 10 |
| Malathion | 101 | 3 | 92 | 4 | 95 | 3 |
| Myclobutanil | 92 | 11 | 93 | 0 | 95 | 11 |
| Bifenazate | 105 | 2 | 98 | 4 | 99 | 2 |
| Ochratoxin A | 111 | 10 | 111 | 0 | 98 | 10 |
| Fenhexamid | 135 | 6 | 102 | 0 | 91 | 6 |
| Spirotetramat | 107 | 7 | 87 | 5 | 95 | 7 |
| Ethoprophos | 104 | 5 | 97 | 2 | 96 | 5 |
| Fipronil | 99 | 12 | 93 | 9 | 96 | 12 |
| Fenoxycarb | 108 | 9 | 97 | 1 | 93 | 9 |
| Kresoxim methyl | 93 | 21 | 108 | 3 | 90 | 21 |
| Tebuconazole | 102 | 6 | 95 | 3 | 97 | 6 |
| Spinosyn A | 100 | 5 | 98 | 2 | 95 | 5 |
| Diazinon | 107 | 2 | 95 | 1 | 96 | 2 |
| Coumaphos | 114 | 7 | 94 | 3 | 97 | 7 |
| Pyridaben | 139 | 18 | 103 | 15 | 94 | 18 |
| Propiconazole | 106 | 2 | 97 | 1 | 95 | 2 |
| Clofentezine | 126 | 14 | 87 | 3 | 92 | 14 |
| Spinosyn D | 104 | 8 | 93 | 8 | 97 | 8 |
| Spinosyn J | 110 | 6 | 92 | 6 | 101 | 6 |
| Trifloxystrobin | 103 | 2 | 95 | 2 | 101 | 2 |
| Prallethrin | 101 | 17 | 103 | 0 | 98 | 17 |
| Pyrethrin II | 92 | 23 | 82 | 5 | 101 | 23 |
| Spinosyn L | 106 | 6 | 95 | 0 | 98 | 6 |
| Piperonyl butoxide | 103 | 2 | 97 | 0 | 96 | 2 |
| Chlorpyrifos | 105 | 10 | 93 | 0 | 91 | 10 |
| Hexythiazox | 121 | 15 | 96 | 0 | 86 | 15 |
| Etoxazole | 102 | 1 | 95 | 1 | 95 | 1 |
| Spiromesifen | 112 | 6 | 95 | 5 | 100 | 6 |
| Pyrethrin I | 131 | 13 | 97 | 4 | 95 | 13 |
| Cyfluthrin | – | – | – | – | 80 | 8 |
| Cypermethrin | – | – | 95 | 16 | 96 | 16 |
| (E)-Fenpyroximate | 107 | 6 | 95 | 4 | 94 | 6 |
| Permethrin-trans | 136 | 22 | 103 | 4 | 94 | 22 |
| Permethrin-cis | 113 | 12 | 98 | 8 | 101 | 12 |
| Avermectin B1a | 122 | 17 | 96 | 0 | 87 | 17 |
| Etofenprox | 110 | 4 | 100 | 2 | 101 | 4 |
| Bifenthrin | 135 | 5 | 98 | 6 | 85 | 5 |
| Acequinocyl | 129 | 5 | 95 | 5 | 78 | 5 |
Tabella X: Limiti di quantificazione (LOQ), linearità, accuratezza e precisione per pesticidi e micotossine nelle caramelle gommose alla cannabis.
| Contaminante | Livello di azione (ng/g) | LOQ (ng/g) | R2 | 10 ng/g (n=4) | 50 ng/g (n=4) | 100 ng/g (n=4) | 500 ng/g (n=4) | ||||
| Accuratezza (%) | Precisione (RSD) | Accuratezza (%) | Precisione (RSD) | Accuratezza (%) | Precisione (RSD) | Accuratezza (%) | Precisione (RSD) | ||||
| Daminozide* | <LOD | 20 | 0.9999 | – | – | 114 | 6 | 114 | 4 | 116 | 4 |
| Acephate | 5000 | 5 | 0.9996 | 100 | 4 | 93 | 3 | 90 | 2 | 88 | 2 |
| Oxamyl | 200 | 5 | 0.999 | 108 | 1 | 102 | 3 | 105 | 4 | 99 | 3 |
| Flonicamid | 2000 | 50 | 0.999 | – | – | 117 | 6 | 105 | 11 | 101 | 4 |
| Methomyl | 100 | 20 | 0.9989 | – | – | 102 | 3 | 103 | 3 | 100 | 1 |
| Thiamethoxam | 4500 | 10 | 0.9988 | 112 | 23 | 108 | 5 | 108 | 6 | 100 | 3 |
| Imidacloprid | 3000 | 10 | 0.9985 | 105 | 17 | 107 | 3 | 109 | 4 | 102 | 5 |
| Mevinphos (I and II)* | <LOD | 20 | 0.9981 | – | – | 101 | 4 | 104 | 7 | 101 | 3 |
| Acetamiprid | 5000 | 10 | 0.9968 | 100 | 8 | 108 | 6 | 109 | 5 | 105 | 1 |
| Dimethoate* | <LOD | 5 | 0.9994 | 109 | 15 | 104 | 3 | 101 | 5 | 99 | 2 |
| Thiacloprid* | <LOD | 20 | 0.9981 | – | – | 100 | 1 | 103 | 4 | 103 | 3 |
| Aflatoxin G2 | 20# | 5 | 0.9957 | 112 | 17 | 101 | 6 | 97 | 2 | – | – |
| Aflatoxin G1 | 20# | 5 | 0.9984 | 114 | 9 | 98 | 1 | 100 | 4 | – | – |
| Aldicarb* | <LOD | 20 | 0.9971 | – | – | 91 | 17 | 104 | 8 | 97 | 4 |
| Aflatoxin B2 | 20# | 5 | 0.9973 | 97 | 23 | 107 | 6 | 94 | 7 | – | – |
| Dichlorvos* | <LOD | 10 | 0.9984 | 98 | 17 | 103 | 4 | 97 | 18 | 106 | 4 |
| Aflatoxin B1 | 20# | 5 | 0.9978 | 113 | 5 | 101 | 6 | 96 | 5 | – | – |
| Imazalil* | <LOD | 5 | 0.9977 | 97 | 19 | 109 | 5 | 107 | 4 | 105 | 3 |
| Carbofuran* | <LOD | 5 | 0.9973 | 93 | 7 | 108 | 1 | 109 | 5 | 99 | 4 |
| Propoxur* | <LOD | 5 | 0.9977 | 108 | 6 | 108 | 2 | 107 | 4 | 102 | 3 |
| Carbaryl | 500 | 5 | 0.9988 | 95 | 14 | 109 | 6 | 108 | 5 | 102 | 2 |
| Naled | 500 | 5 | 0.9968 | 98 | 4 | 112 | 8 | 110 | 3 | 101 | 5 |
| Metalaxyl | 15,000 | 5 | 0.9988 | 101 | 5 | 105 | 4 | 106 | 5 | 99 | 3 |
| Spiroxamine* | <LOD | 5 | 0.9977 | 104 | 6 | 106 | 2 | 105 | 2 | 101 | 3 |
| Chlorantraniliprole | 40,000 | 20 | 0.9971 | – | – | 93 | 7 | 104 | 6 | 104 | 5 |
| Phosmet | 200 | 5 | 0.9992 | 109 | 14 | 105 | 3 | 104 | 3 | 100 | 4 |
| Azoxystrobin | 40,000 | 5 | 0.9992 | 100 | 3 | 104 | 1 | 105 | 4 | 102 | 3 |
| Fludioxonil | 30,000 | 20 | 0.9949 | – | – | 109 | 13 | 97 | 6 | 101 | 6 |
| Methiocarb* | <LOD | 5 | 0.9988 | 116 | 16 | 105 | 5 | 107 | 5 | 101 | 4 |
| Dimethomorph (I and II) | 20,000 | 10 | 0.999 | 75 | 14 | 101 | 6 | 93 | 8 | 101 | 5 |
| Boscalid | 10,000 | 10 | 0.9964 | 108 | 15 | 102 | 12 | 102 | 2 | 103 | 3 |
| Paclobutrazol* | <LOD | 10 | 0.9979 | 99 | 9 | 106 | 1 | 108 | 3 | 100 | 4 |
| Malathion | 5000 | 10 | 0.9989 | 117 | 12 | 112 | 3 | 106 | 2 | 101 | 3 |
| Myclobutanil | 9000 | 10 | 0.9986 | 102 | 22 | 102 | 6 | 104 | 3 | 101 | 3 |
| Bifenazate | 5000 | 10 | 0.9994 | 118 | 20 | 110 | 3 | 104 | 10 | 102 | 5 |
| Ochratoxin A | 20 | 10 | 0.9957 | 99 | 8 | 99 | 24 | 104 | 8 | – | – |
| Fenhexamid | 10,000 | 10 | 0.9969 | 96 | 21 | 109 | 4 | 106 | 3 | 107 | 5 |
| Spirotetramat | 13,000 | 10 | 0.9987 | 83 | 18 | 107 | 6 | 106 | 3 | 105 | 3 |
| Ethoprophos* | <LOD | 5 | 0.9985 | 101 | 3 | 106 | 4 | 104 | 1 | 102 | 3 |
| Fipronil* | <LOD | 20 | 0.998 | – | – | 96 | 5 | 104 | 8 | 103 | 4 |
| Fenoxycarb* | <LOD | 10 | 0.9967 | 115 | 5 | 106 | 4 | 107 | 2 | 102 | 3 |
| Kresoxym-methyl | 1000 | 10 | 0.9993 | 112 | 20 | 104 | 10 | 102 | 4 | 103 | 3 |
| Tebuconazole | 2000 | 5 | 0.999 | 100 | 3 | 110 | 1 | 105 | 3 | 101 | 4 |
| Spinosad- spinosyn A (71 %)a | 3000¥ | 7.1 | 0.9988 | 117 | 2 | 110 | 3 | 108 | 2 | 102 | 1 |
| Diazinon | 200 | 5 | 0.9997 | 104 | 1 | 102 | 1 | 104 | 2 | 101 | 1 |
| Coumaphos* | <LOD | 10 | 0.9991 | 107 | 11 | 109 | 5 | 108 | 2 | 103 | 2 |
| Pyridaben | 3000 | 50 | 0.9994 | – | – | 93 | 12 | 113 | 6 | 103 | 1 |
| Propiconazole | 20,000 | 5 | 0.9991 | 96 | 6 | 108 | 4 | 104 | 5 | 103 | 3 |
| Clofentezine | 500 | 20 | 0.9978 | – | – | 102 | 5 | 105 | 3 | 106 | 4 |
| Spinosad – spinosyn D (29%)b | 3000¥ | 2.9 | 0.9993 | 106 | 8 | 101 | 2 | 103 | 5 | 104 | 4 |
| Spinetoram – spinosyn J (80%)c | 3000§ | 4 | 0.9995 | 104 | 7 | 102 | 3 | 108 | 4 | 102 | 2 |
| Trifloxystrobin | 30,000 | 5 | 0.9996 | 107 | 3 | 106 | 3 | 106 | 3 | 104 | 2 |
| Prallethrin | 400 | 10 | 0.9967 | 107 | 21 | 99 | 16 | 111 | 6 | 101 | 3 |
| Pyrethrin II (34%)f | 1000£ | 17 | 0.9977 | – | – | 94 | 11 | 112 | 4 | 106 | 6 |
| Spinetoram – spinosyn L (20%)d | 3000§ | 2 | 0.9993 | 107 | 10 | 109 | 4 | 107 | 3 | 102 | 1 |
| Piperonyl Butoxide | 8000 | 5 | 0.9998 | 110 | 5 | 99 | 2 | 94 | 3 | 95 | 5 |
| Chlorpyrifos* | <LOD | 20 | 0.9995 | – | – | 103 | 9 | 106 | 4 | 104 | 5 |
| Hexythiazox | 2000 | 10 | 0.9975 | 104 | 15 | 102 | 3 | 107 | 4 | 106 | 5 |
| Etoxazole | 1500 | 5 | 0.9995 | 103 | 4 | 104 | 2 | 103 | 1 | 100 | 1 |
| Spiromesifen | 12,000 | 5 | 0.9992 | 98 | 8 | 109 | 7 | 111 | 2 | 102 | 2 |
| Pyrethrin I (54%)e | 1000£ | 11 | 0.9977 | – | – | 98 | 5 | 105 | 12 | 104 | 5 |
| Cyfluthrin | 1000 | 50 | 0.999 | – | – | 93 | 11 | 102 | 23 | 115 | 10 |
| Cypermethrin | 1000 | 50 | 0.9961 | – | – | 115 | 11 | 98 | 18 | 104 | 6 |
| (E)-Fenpyroximate | 2000 | 5 | 0.9995 | 102 | 9 | 109 | 3 | 109 | 2 | 105 | 2 |
| Permethrin-trans (59%)h | 20,000¢ | 12 | 0.9994 | – | – | 99 | 8 | 104 | 5 | 101 | 3 |
| Permethrin-cis (41%)g | 20,000¢ | 8 | 0.9996 | 95 | 5 | 104 | 5 | 103 | 4 | 101 | 3 |
| Avermectin B1a | 300 | 50 | 0.9988 | – | – | 114 | 3 | 108 | 2 | 105 | 2 |
| Etofenprox* | <LOD | 5 | 0.9994 | 104 | 7 | 107 | 1 | 106 | 2 | 103 | 1 |
| Bifenthrin | 500 | 5 | 0.999 | 99 | 5 | 103 | 2 | 108 | 6 | 104 | 2 |
| Acequinocyl | 4000 | 10 | 0.9997 | 104 | 7 | 109 | 3 | 108 | 3 | 106 | 2 |
| Quintozene (PCNB) (GC) | 200 | 10 | 0.9966 | 110 | 14 | 102 | 5 | 101 | 1 | 97 | 3 |
| Methyl parathion (GC)* | <LOD | 5 | 0.9934 | 89 | 10 | 89 | 5 | 87 | 3 | 89 | 6 |
| Captan (GC) | 5000 | 10 | 0.9924 | 110 | 14 | 96 | 10 | 94 | 18 | 92 | 7 |
| Chlordane (GC)* | <LOD | 20 | 0.9913 | – | – | 105 | 9 | 93 | 8 | 85 | 10 |
| Chlorfenapyr (GC)* | <LOD | 10 | 0.9924 | 97 | 9 | 90 | 19 | 89 | 6 | 85 | 13 |
| Cyfluthrin (GC) | 1000 | 5 | 0.9935 | 107 | 10 | 92 | 18 | 91 | 7 | 89 | 11 |
| Cypermethrin (GC) | 1000 | 5 | 0.9938 | 95 | 9 | 83 | 17 | 97 | 15 | 93 | 9 |
*Category I pesticides, LOQ ≤100 ng/g
aSpinosad- spinosyn A: Conc. 1: 7 ng/g; Conc. 2: 35.5 ng/g; Conc. 3: 71 ng/g; Conc. 4: 355 ng/g
bSpinosad – spinosyn D: Conc. 1: 3 ng/g; conc. 2: 14.5 ng/g; Conc. 3: 29 ng/g; Conc. 4: 145 ng/g
cSpinetoram – spinosyn J: Conc. 1: 8 ng/g; Conc. 2: 40 ng/g; Conc. 3: 80 ng/g; Conc. 4: 400 ng/g
dSpinetoram – spinosyn L: Conc. 1: 2 ng/g; Conc. 2: 10 ng/g; Conc. 3: 20 ng/g; Conc. 4: 100 ng/g
ePyrethrin I: Conc. 1: 5 ng/g; Conc. 2: 27 ng/g; Conc. 3: 54 ng/g; Conc. 4: 270 ng/g
fPyrethrin II: Conc. 1: 3 ng/g; Conc. 2: 17 ng/g; Conc. 3: 34 ng/g; Conc. 4: 170 ng/g
gPermethrin-cis: Conc. 1: 4 ng/g; Conc. 2: 20.5 ng/g; Conc. 3: 41 ng/g; Conc. 4: 205 ng/g
hPermethrin-trans: Conc. 1: 6 ng/g; Conc. 2: 29.5 ng/g; Conc. 3: 59 ng/g; Conc. 4: 295 ng/g
#Total of aflatoxin B1, B2, G1, and G2 should not exceed 20 ng/g.
¥Total spinosad should not exceed 3000 ng/g.
§Total spinetoram should not exceed 3000 ng/g.
£ Total pyrethrins should not exceed 1000 ng/g.
¢Total permethrins should not exceed 20,000 ng/g.
Tabella XI: Linearità per i cannabinoidi nelle caramelle gommose alla cannabis.
| Cannabinoidi | Tempo di ritenzione | R2 | Equazione |
| Cannabidiolic acid (CBDA) | 2.142 | 0.9993 | y = 2.08e+004x + 1.03e+003 |
| Cannabigerol (CBG) | 2.405 | 0.9981 | y = 1.16e+004x + 1.85e+003 |
| Cannabidiol (CBD) | 2.535 | 0.9972 | y = 1.17e+004x + 1.42e+003 |
| Cannabinol (CBN) | 3.776 | 0.9980 | y = 2.70e+004x + 6.14e+004 |
| Delta-9-tetrahydrocannabinol (Delta-9-THC) | 4.753 | 0.9970 | y = 1.06e+004x + 7.29e+003 |
| Tetrahydrocannabinolic acid (THCA) | 6.279 | 0.9986 | y = 1.78e+004x – 1.28e+003 |
Tabella XII: Accuratezza e precisione per i cannabinoidi nelle caramelle alla cannabis.
| Cannabinoide/Livello di fortificazione | Conc. estratto diluito (ppm) | Media (ppm) | SD | RSD (%) | Conc. estratto non diluito (ppm) | Conc. stimata del campione (mg/g) | Accuracy (%) | Errore percentuale | |
| Caramelle fortificate a 0,2 mg/g | Replica 1 | Replica 2 | |||||||
| Cannabidiolic acid (CBDA) | 4.2 | 4.4 | 4.3 | 0.1 | 3 | 43 | 0.2 | 107 | 7 |
| Cannabigerol (CBG) | 4.0 | 3.9 | 4.0 | 0.1 | 2 | 40 | 0.2 | 99 | 1 |
| Cannabidiol (CBD) | 4.1 | 4.2 | 4.1 | 0.1 | 2 | 41 | 0.2 | 103 | 3 |
| Cannabinol (CBN) | 4.0 | 4.1 | 4.1 | 0.1 | 3 | 41 | 0.2 | 101 | 1 |
| Delta-9 tetrahydrocannabinol (Delta 9 THC) | 4.0 | 4.2 | 4.1 | 0.1 | 3 | 41 | 0.2 | 103 | 3 |
| Tetrahydrocannabinolic acid (THCA) | 4.1 | 4.3 | 4.2 | 0.1 | 3 | 42 | 0.2 | 105 | 5 |
| Gummy spiked at 0.5 mg/g | |||||||||
| Cannabidiolic acid (CBDA) | 10.4 | 10.7 | 10.6 | 0.2 | 2 | 106 | 0.5 | 106 | 6 |
| Cannabigerol (CBG) | 9.5 | 10.3 | 9.9 | 0.5 | 5 | 99 | 0.5 | 99 | 1 |
| Cannabidiol (CBD) | 9.8 | 10.6 | 10.2 | 0.5 | 5 | 102 | 0.5 | 102 | 2 |
| Cannabinol (CBN) | 9.8 | 10.3 | 10.0 | 0.4 | 4 | 100 | 0.5 | 100 | 0 |
| Delta-9-tetrahydrocannabinol (Delta-9-THC) | 9.9 | 10.3 | 10.1 | 0.3 | 3 | 101 | 0.5 | 101 | 1 |
| Tetrahydrocannabinolic acid (THCA) | 10.3 | 9.9 | 10.1 | 0.2 | 2 | 101 | 0.5 | 101 | 1 |
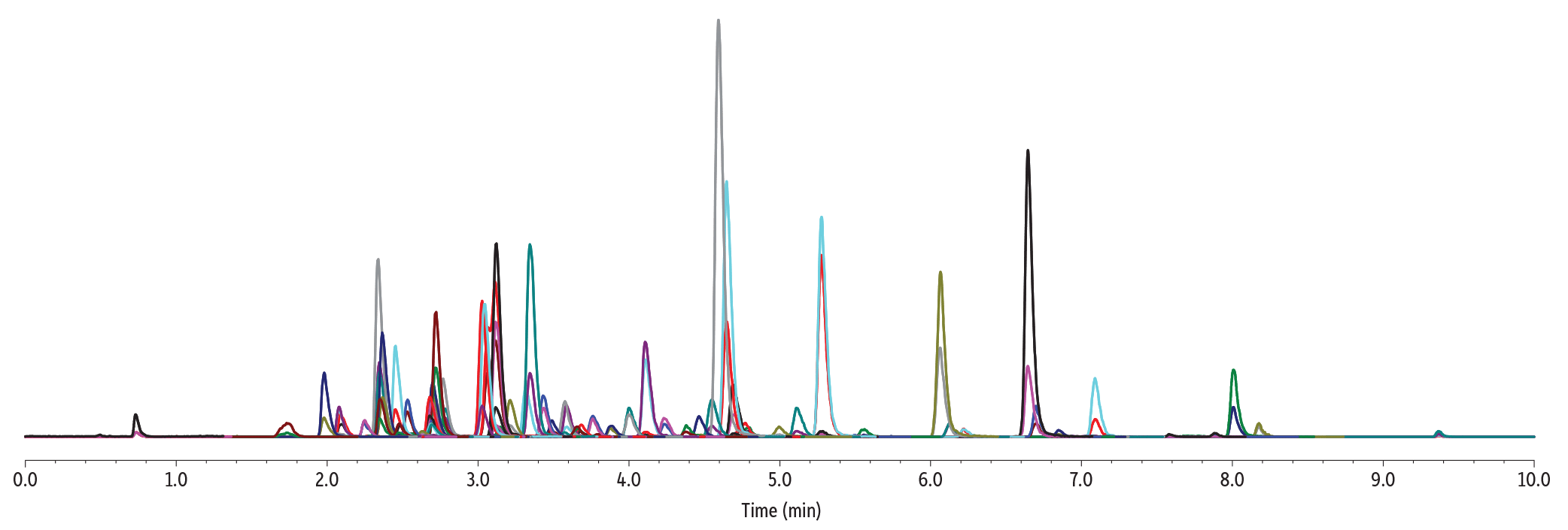
LC_GN0666
Peaks
| Peaks | tR (min) | Precursor Ion | Product Ion 1 | Product Ion 2 | Polarity | |
|---|---|---|---|---|---|---|
| 1. | Daminozide-d6 | 0.7 | 167.0 | 149.3 | 49.3 | + |
| 2. | Daminozide | 0.7 | 161.1 | 44.1 | 143.2 | + |
| 3. | Acephate | 1.7 | 184.0 | 143.1 | 95.1 | + |
| 4. | Oxamyl | 2.0 | 237.1 | 72.1 | 90.1 | + |
| 5. | Flonicamid | 2.1 | 230.1 | 203.1 | 174.1 | + |
| 6. | Methomyl | 2.1 | 163.1 | 88.1 | 106.1 | + |
| 7. | Thiamethoxam | 2.1 | 292.0 | 211.1 | 181.1 | + |
| 8. | Imidacloprid | 2.3 | 256.1 | 209.1 | 175.1 | + |
| 9. | Mevinphos | 2.4 | 225.1 | 127.1 | 193.2 | + |
| 10. | Acetamiprid | 2.4 | 223.0 | 126.1 | 56.1 | + |
| 11. | Dimethoathe-d6 | 2.4 | 236.1 | 205.1 | – | + |
| 12. | Dimethoate | 2.4 | 230.0 | 199.1 | 125.1 | + |
| 13. | Thiacloprid | 2.5 | 253.0 | 126.0 | 90.1 | + |
| 14. | Aflatoxin G2 | 2.5 | 331.2 | 189.3 | 115.2 | + |
| 15. | Aflatoxin G1 | 2.5 | 329.2 | 243.2 | 215.3 | + |
| 16. | Aldicarb | 2.6 | 116.0 | 89.2 | 70.2 | + |
| 17. | Aflatoxin B2 | 2.6 | 315.3 | 287.2 | 243.3 | + |
| 18. | Dichlorvos | 2.7 | 220.9 | 109.1 | 79.2 | + |
| 19. | Dichlorvos-d6 | 2.7 | 227.0 | 115.1 | – | + |
| 20. | Aflatoxin B1 | 2.7 | 313.2 | 241.2 | 128.2 | + |
| 21. | Imazalil | 2.7 | 297.0 | 159.0 | 201.0 | + |
| 22. | Carbofuran | 2.7 | 222.1 | 123.1 | 165.2 | + |
| 23. | Propoxur | 2.7 | 210.1 | 111.1 | 93.1 | + |
| 24. | Carbaryl-d7 | 2.8 | 209.2 | 152.2 | – | + |
| 25. | Carbaryl | 2.8 | 202.1 | 145.1 | 127.1 | + |
| 26. | Diuron-d6 | 3.0 | 239.1 | 78.2 | – | + |
| 27. | Atrazine-d5 | 3.0 | 221.2 | 179.1 | – | + |
| 28. | Naled | 3.1 | 397.8 | 127.1 | 109.1 | + |
| 29. | Metalaxyl | 3.1 | 280.2 | 220.2 | 192.2 | + |
| 30. | Spiroxamine | 3.1 | 298.3 | 144.2 | 100.2 | + |
| 31. | Chlorantraniliprole | 3.2 | 483.9 | 452.9 | 285.9 | + |
| 32. | Phosmet | 3.2 | 318.0 | 160.1 | 77.2 | + |
| 33. | Azoxystrobin | 3.3 | 404.0 | 372.1 | 344.1 | + |
| 34. | Linuron-d6 | 3.3 | 255.1 | 160.1 | – | + |
| 35. | Fludioxonil | 3.4 | 247.0 | 180.0 | 126.0 | – |
| 36. | Methiocarb | 3.4 | 226.1 | 169.1 | 121.1 | + |
| 37. | Dimethomorph | 3.5 | 388.2 | 301.2 | 165.3 | + |
| 38. | Boscalid | 3.5 | 342.9 | 307.1 | 140.1 | + |
| 39. | Paclobutrazol | 3.6 | 294.3 | 70.1 | 125.1 | + |
| 40. | Malathion | 3.6 | 331.0 | 127.2 | 285.2 | + |
| 41. | Myclobutanil | 3.7 | 289.1 | 70.1 | 125.1 | + |
| 42. | Bifenazate | 3.7 | 301.0 | 198.1 | 170.2 | + |
| 43. | Ochratoxin A | 3.8 | 404.2 | 239.1 | 358.3 | + |
| 44. | Fenhexamid | 3.9 | 302.1 | 97.1 | 55.2 | + |
| 45. | Spirotetramat | 4.0 | 374.2 | 302.1 | 216.1 | + |
| 46. | Ethoprophos | 4.1 | 243.1 | 131.1 | 97.1 | + |
| 47. | Fipronil | 4.1 | 436.8 | 331.8 | 251.9 | – |
| 48. | Fenoxycarb | 4.2 | 302.1 | 88.1 | 116.1 | + |
| 49. | Kresoxim-methyl | 4.4 | 314.2 | 267.2 | 222.2 | + |
| 50. | Tebuconazole | 4.4 | 308.1 | 70.1 | 125.1 | + |
| 51. | Diazinon-d10 | 4.6 | 315.2 | 170.2 | – | + |
| 52. | Spinosyn A (Spinosad) | 4.6 | 732.4 | 142.2 | 98.1 | + |
| 53. | Diazinon | 4.6 | 305.1 | 169.2 | 153.2 | + |
| 54. | Coumaphos | 4.7 | 363.1 | 227.1 | 307.1 | + |
| 55. | Pyridaben | 4.7 | 365.1 | 309.2 | 147.2 | + |
| 56. | Propiconazole | 4.7 | 342.0 | 159.0 | 69.2 | + |
| 57. | Clofentezine | 4.8 | 303.0 | 138.1 | 102.1 | + |
| 58. | Spinosyn D (Spinosad) | 5.0 | 746.5 | 142.3 | 98.4 | + |
| 59. | Spinosyn J (Spinetoram) | 5.1 | 748.5 | 142.3 | 98.3 | + |
| 60. | Trifloxystrobin | 5.3 | 409.2 | 186.1 | 145.1 | + |
| 61. | Prallethrin | 5.3 | 301.2 | 123.2 | 105.2 | + |
| 62. | Pyrethrin II | 5.5 | 373.1 | 161.1 | 133.2 | + |
| 63. | Spinosyn L (Spinetoram) | 5.6 | 760.5 | 142.2 | 98.1 | + |
| 64. | Piperonyl butoxide | 6.0 | 356.3 | 177.2 | 119.2 | + |
| 65. | Chlorpyrifos | 6.1 | 349.9 | 198.0 | 97.1 | + |
| 66. | Hexythiazox | 6.2 | 353.1 | 228.1 | 168.1 | + |
| 67. | Etoxazole | 6.6 | 360.2 | 141.1 | 304.2 | + |
| 68. | Spiromesifen | 6.7 | 273.2 | 255.2 | 187.2 | + |
| 69. | Pyrethrin I | 6.9 | 329.2 | 161.2 | 105.2 | + |
| 70. | Cyfluthrin (qualifier) | 6.9 | 453.1 | 193.2 | – | + |
| 71. | Cyfluthrin | 6.9 | 451.1 | 191.2 | – | + |
| 72. | Cypermethrin | 7.1 | 433.1 | 191.0 | 416.0 | + |
| 73. | (E)-Fenpyroximate | 7.1 | 422.2 | 366.1 | 138.1 | + |
| 74. | trans-Permethrin | 7.6 | 408.3 | 183.2 | 355.1 | + |
| 75. | cis-Permethrin | 7.9 | 408.3 | 183.2 | 355.1 | + |
| 76. | Avermectin B1a | 7.9 | 890.5 | 305.4 | 567.4 | + |
| 77. | Etofenprox | 8.0 | 394.3 | 177.2 | 359.3 | + |
| 78. | Bifenthrin | 8.2 | 440.0 | 181.2 | 166.2 | + |
| 79. | Acequinocyl (precursor ion 1) | 9.4 | 402.3 | 343.2 | 189.0 | + |
| 80. | Acequinocyl (precursor ion 2) | 9.4 | 386.0 | 344.2 | 189.1 | + |
Conditions
| Column | Raptor ARC-18 (cat.# 9314A12) | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 100 mm x 2.1 mm ID | ||||||||||||||||||||||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||||||||||
| Guard Column: | Raptor ARC-18 EXP guard column cartridge 5 mm, 2.1 mm ID, 2.7 µm (cat.# 9314A0252) | ||||||||||||||||||||||||||||||||
| Temp.: | 40 °C | ||||||||||||||||||||||||||||||||
| Standard/Sample | |||||||||||||||||||||||||||||||||
| California pesticide standard #1 (cat.# 34124) | |||||||||||||||||||||||||||||||||
| California pesticide standard #2 (cat.# 34125) | |||||||||||||||||||||||||||||||||
| California pesticide standard #3 (cat.# 34126) | |||||||||||||||||||||||||||||||||
| California pesticide standard #4 (cat.# 34127) | |||||||||||||||||||||||||||||||||
| California pesticide standard #5 (cat.# 34128) | |||||||||||||||||||||||||||||||||
| California pesticide standard #6 (cat.# 34129) | |||||||||||||||||||||||||||||||||
| Dimethoate-d6 (cat.# 31988) | |||||||||||||||||||||||||||||||||
| Dichlorvos-d6 (cat.# 31987) | |||||||||||||||||||||||||||||||||
| Carbaryl-d7 (cat.# 31985) | |||||||||||||||||||||||||||||||||
| Diazinon-d10 (cat.# 31986) | |||||||||||||||||||||||||||||||||
| Atrazine-d5 (cat.# 31984) | |||||||||||||||||||||||||||||||||
| Diuron-d6 (cat.# 31989) | |||||||||||||||||||||||||||||||||
| Liuron-d6 (cat.# 31990) | |||||||||||||||||||||||||||||||||
| Aflatoxins standard (cat.# 34121) | |||||||||||||||||||||||||||||||||
| Ochratoxin A (cat.# 34122) | |||||||||||||||||||||||||||||||||
| Compounds not present in these mixes were obtained separately. | |||||||||||||||||||||||||||||||||
| Diluent: | 75:25 Acetonitrile:water | ||||||||||||||||||||||||||||||||
| Conc.: | 3.75-15 ng/mL (Expected concentration range in extract of gummy initially spiked at 100 ng/g.) | ||||||||||||||||||||||||||||||||
| Inj. Vol.: | 2 µL | ||||||||||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||||||||||
| A: | Water, 2 mM ammonium formate, 0.1% formic acid | ||||||||||||||||||||||||||||||||
| B: | Methanol, 2 mM ammonium formate, 0.1% formic acid | ||||||||||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI+/ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
| Sample Preparation | Gummies were manually chopped into small pieces, and 1 g of sample was weighed in a 50 mL polypropylene tube. The sample was mixed with 5 mL of water and then vigorously vortexed until all gummy pieces were fully solubilized. The sample was fortified with pesticides and mycotoxins at 100 ng/g. A mix of internal standards was added at 200 ng/g. The spiked sample was further vortexed for 30 sec. 5 mL of acetonitrile acidified with 1% acetic acid was added to the sample, and this was followed by a 30 sec vortex agitation. Then, a pouch of European EN 15662 QuEChERS extraction salts (cat.# 25849) was added to the sample. The sample was vortexed for 30 sec and then centrifuged for 5 min. 750 µL of organic extract was mixed with 250 µL of water. 2 μL of final extract was injected into the LC-MS/MS system. |
| Notes | Want even better performance when analyzing metal-sensitive compounds? Check out Inert LC columns at www.restek.com/inert. |
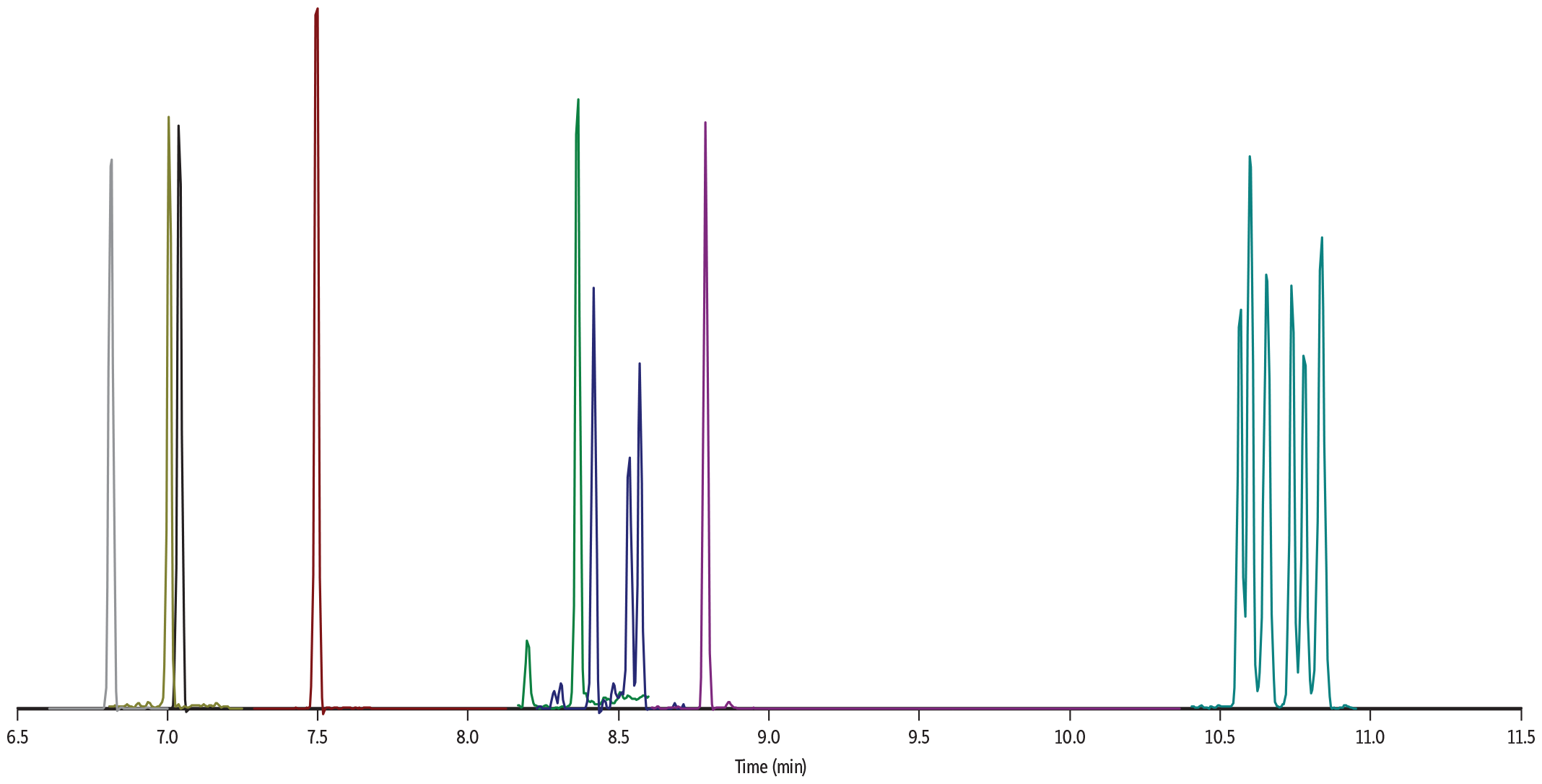
GC_GN1207
Peaks
| Peaks | tR (min) | Polarity | Precursor Ion | Product Ion | Transition Type | |
|---|---|---|---|---|---|---|
| 1. | Atrazine-d5 | 6.82 | Positive | 220.0 | 58.0 | Quantifier |
| 2. | Atrazine-d5 | 6.82 | Positive | 205.0 | 127.0 | Qualifier |
| 3. | Diazinon-d10 (diethyl-d10) | 7.01 | Positive | 183.0 | 139.0 | Quantifier |
| 4. | Diazinon-d10 (diethyl-d10) | 7.01 | Positive | 183.0 | 168.0 | Qualifier |
| 5. | Quintozene | 7.03 | Positive | 294.9 | 236.9 | Quantifier |
| 6. | Quintozene | 7.03 | Positive | 236.8 | 118.9 | Qualifier |
| 7. | Methyl parathion | 7.50 | Positive | 263.0 | 109.0 | Quantifier |
| 8. | Methyl parathion | 7.50 | Positive | 263.0 | 79.0 | Qualifier |
| 9. | Captan | 8.37 | Positive | 184.0 | 149.1 | Quantifier |
| 10. | Captan | 8.37 | Positive | 184.0 | 134.1 | Qualifier |
| 11. | trans-Chlordane | 8.41 | Positive | 271.9 | 237.0 | Quantifier |
| 12. | trans-Chlordane | 8.41 | Positive | 372.9 | 265.9 | Qualifier |
| 13. | cis-Chlordane | 8.53 | Positive | 372.9 | 265.9 | Quantifier |
| 14. | cis-Chlordane | 8.53 | Positive | 271.9 | 237.0 | Qualifier |
| 15. | Chlorfenapyr | 8.80 | Positive | 247.1 | 227.1 | Quantifier |
| 16. | Chlorfenapyr | 8.80 | Positive | 59.1 | 31.1 | Qualifier |
| 17. | Cyfluthrin | 10.61 | Positive | 226.0 | 206.0 | Quantifier |
| 18. | Cyfluthrin | 10.61 | Positive | 163.0 | 127.0 | Qualifier |
| 19. | Cypermethrin | 10.87 | Positive | 163.0 | 127.1 | Quantifier |
| 20. | Cypermethrin | 10.87 | Positive | 181.1 | 152.1 | Qualifier |
Conditions
| Column | Rxi-5ms, 30 m, 0.25 mm ID, 0.25 µm (cat.# 13423) |
|---|---|
| Standard/Sample | |
| California pesticide standard #1 (cat.# 34124) | |
| California pesticide standard #2 (cat.# 34125) | |
| California pesticide standard #3 (cat.# 34126) | |
| California pesticide standard #4 (cat.# 34127) | |
| California pesticide standard #5 (cat.# 34128) | |
| California pesticide standard #6 (cat.# 34129) | |
| Atrazine-d5 (cat.# 31984) | |
| Diazinon-d10 (cat.# 31986) | |
| Diluent: | Acetonitrile |
| Conc.: | 2.5-10 ng/mL Expected concentration range in extract after extracting from gummy fortified at 100 ng/g (final extract was diluted in half with acetonitrile). |
| Injection | |
| Inj. Vol.: | 1 µL splitless |
| Liner: | Topaz 4.0 mm ID single taper inlet liner w/wool (cat.# 23447) |
| Inj. Temp.: | 250 °C |
| Purge Flow: | 5 mL/min |
| Oven | |
| Oven Temp.: | 90 °C (hold 1 min) to 310 °C at 25 °C/min (hold 10 min) |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1.4 mL/min |
| Detector | MS/MS |
|---|---|
| Transfer Line Temp.: | 290 °C |
| Analyzer Type: | Quadrupole |
| Source Temp.: | 330 °C |
| Electron Energy: | 70 eV |
| Tune Type: | PFTBA |
| Ionization Mode: | EI |
| Instrument | Thermo Scientific TSQ 8000 Triple Quadrupole GC-MS |
| Sample Preparation | Gummies were manually chopped into small pieces, and 1 g of sample was weighed in a 50 mL polypropylene tube. The sample was mixed with 5 mL of water and then vigorously vortexed until all gummy pieces were fully solubilized. The sample was fortified with pesticides and mycotoxins at 100 ng/g. A mix of internal standards was added at 200 ng/g. The spiked sample was further vortexed for 30 sec. 5 mL of acetonitrile acidified with 1% acetic acid was added to the sample, and this was followed by 30 sec vortex agitation. Then, a pouch of European EN 15662 QuEChERS extraction salts (cat.# 25849) was added to the sample. The sample was vortexed for 30 sec and then centrifuged for 5 min. 1.9 mL of supernatant was transferred to a Q-sep QuEChERS dSPE tube containing pre-weighed magnesium sulfate, PSA, and GCB (cat.# 26217). After vortexing and centrifuging, 500 μL of extract was mixed with 500 μL of acidified acetonitrile. 1 μL of final extract was injected into the GC-MS/MS system. |
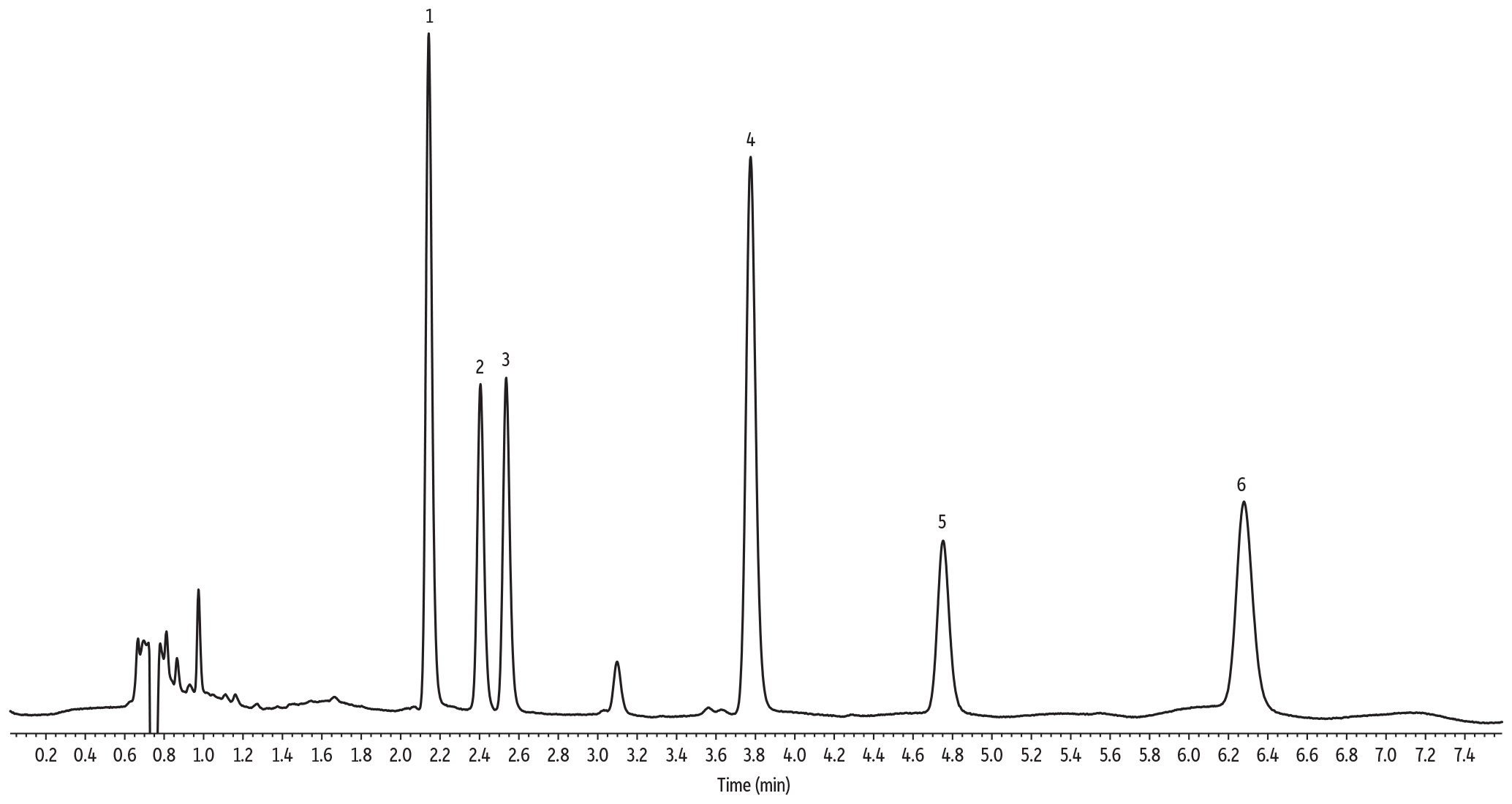
LC_GN0667
Peaks
| Peaks | tR (min) | mg/g* | |
|---|---|---|---|
| 1. | Cannabidiolic acid (CBDA) | 2.142 | 0.2 |
| 2. | Cannabigerol (CBG) | 2.405 | 0.2 |
| 3. | Cannabidiol (CBD) | 2.535 | 0.2 |
| 4. | Cannabinol (CBN) | 3.776 | 0.2 |
| 5. | Δ9-Tetrahydrocannabinol (Δ9-THC) | 4.753 | 0.2 |
| 6. | Tetrahydrocannabinolic acid A (THCA-A) | 6.279 | 0.2 |
Conditions
| Column | Raptor ARC-18 (cat.# 9314A62) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 150 mm x 2.1 mm ID | ||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||
| Pore Size: | 90 Å | ||||||||||||
| Guard Column: | Raptor ARC-18 EXP guard column cartridge 5 mm, 2.1 mm ID, 2.7 µm (cat.# 9314A0252) | ||||||||||||
| Temp.: | 30 °C | ||||||||||||
| Standard/Sample | |||||||||||||
| Cannabinoids standard (cat.# 34014) | |||||||||||||
| Cannabigerol (cat.# 34091) | |||||||||||||
| d9-Tetrahydrocannabinol (cat.# 34067) | |||||||||||||
| d9-Tetrahydrocannabinolic acid A (cat.# 34111) | |||||||||||||
| Diluent: | 75:25 Acetonitrile:water | ||||||||||||
| Conc.: | Expected concentration of 4 ppm in final extract from gummy initially spiked at 0.2 mg/g. | ||||||||||||
| Inj. Vol.: | 2 µL | ||||||||||||
| Mobile Phase | |||||||||||||
| A: | Water, 5 mM ammonium formate, 0.1% formic acid | ||||||||||||
| B: | Acetonitrile, 0.1% formic acid | ||||||||||||
|
| Detector | UV/Vis @ 228 nm |
|---|---|
| Instrument | UHPLC |
| Sample Preparation | Gummies were manually chopped into small pieces, and 1 g of sample was weighed in a 50 mL polypropylene tube. The sample was mixed with 5 mL of water and then vigorously vortexed until all gummy pieces were fully solubilized. The sample was fortified with cannabinoids at 0.2 mg/g. The spiked sample was further vortexed for 30 sec. 5 mL of acetonitrile acidified with 1% acetic acid was added to the sample, and this was followed by 30 sec vortex agitation. Then, a pouch of European EN 15662 QuEChERS extraction salts (cat.# 25849) was added to the sample. The sample was vortexed for 30 sec and then centrifuged for 5 min. 100 µL of organic extract was mixed with 900 µL of 75:25 acetonitrile:water. 2 µL of final extract was injected into the HPLC-UV system. |
Conclusioni
È stato sviluppato un flusso di lavoro semplice ed efficace per l’analisi di pesticidi, micotossine e cannabinoidi nelle caramelle gommose alla cannabis. Le condizioni per la preparazione del campione includono l’omogenizzazione della matrice di pezzi di caramelle in acqua, l’estrazione degli analiti con acetonitrile acidificato seguita da una fase di salting-out con i sali di estrazione Q-sep QuEChERS, la diluizione dell’estratto (per i contaminanti e cannabinoidi analizzabili in LC-MS/MS) e infine la purificazione dSPE, per la quale si è utilizzato solfato di magnesio, PSA e GCB (per i pesticidi compatibili con GC-MS/MS). Per tutti i contaminanti target sono stati ottenuti risultati eccellenti in termini di LOQ, linearità, accuratezza e precisione. Inoltre, i dati hanno mostrato che la metodologia proposta è idonea per l’analisi di potenza, offrendo valori di accuratezza fra il 99% e il 107% per i sei cannabinoidi elencati dalle normative del governo californiano. In generale, il flusso di lavoro presentato snellisce il lavoro di laboratorio per l’analisi della cannabis in quanto permette una quantificazione eccellente di diverse classi di analiti in campioni di caramelle gommose utilizzando un solo estratto.
Bibliografia
- Text of Regulations, Bureau of Cannabis Control, California Code of Regulations, https://cannabis.ca.gov/wp-content/uploads/sites/13/2019/01/Order-of-Adoption-Clean-Version-of-Text.pdf, (accessed 8 November 2019).
- X. Wang, D. Mackowsky, J. Searfoss, M. J. Telepchak, Determination of cannabinoid content and pesticide residues in cannabis edibles and beverages, Cannabis Sci. and Tech. (2018). https://www.cannabissciencetech.com/view/determination-cannabinoid-content-and-pesticide-residues-cannabis-edibles-and-beverages.
- Fast, low-solvent analysis of cannabinoids increases lab productivity and decreases solvent costs, Restek Corporation. https://www.restek.com/Technical-Resources/Technical-Library/Foods-Flavors-Fragrances/fff_FFFA3123-UNV (accessed 22 January 2021).
- N. Reyes-Garces, C. Myers, Analysis of pesticides and mycotoxins cannabis brownies, Restek Corporation. https://www.restek.com/Technical-Resources/Technical-Library/Foods-Flavors-Fragrances/fff_FFAN3149-UNV (accessed 3 December 2020).
- B. K. Matuszewski, M. L. Constanzer, C. M. Chavez-Eng, Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC−MS/MS, Anal. Chem. 75 (2003) 3019–3030. https://pubs.acs.org/doi/10.1021/ac020361s


