概要
THCの代謝物検査の重要性は、法医学・医療現場において近年ますます高まっています。しかし、Δ8-THC、Δ9-THCなどの異性体およびそれらの代謝物は化学構造が非常に類似しているため、従来の分析法では正確に識別することが困難です。そこで本研究では、この課題を解決するために、全血および尿サンプルを対象とした新たなLC-MS/MS分析法を開発しました。
はじめに
テトラヒドロカンナビノール(Δ9-THC)の摂取に関する血液および尿の検査は、薬物使用の判定やモニタリングの手法として長年用いられてきました。体内に取り込まれたΔ9-THCは、11-ノル-9-カルボキシ-Δ9-THC(Δ9-THC-COOH)へと代謝され、これらが血液や尿から検出されます。これまで、Δ9-THCとその代謝物であるΔ9-THC-COOHの二つだけが、THC摂取判定の主要指標とされてきました [1]。しかし、より多様なΔ9-THC異性体が市場で流通するようになったことで、検査は急激に複雑化しています。特に、ヘンプ(麻)由来製品を合法化した2018年の農業法案の成立以降、その規制の抜け穴を利用した新たな異性体の流通が問題となっています。その一つであるΔ8-THCは、体内に取り込まれると11-ノル-9-カルボキシ-Δ8-THC(Δ8-THC-COOH)という代謝物に変換されます。このΔ8-THC-COOHは、従来の主要指標であるΔ9-THC-COOHと化学構造が非常に類似しています。そのため、これら2つの代謝物分離が不十分な場合、特に一方の異性体が高濃度で存在する状況下では、検査結果が誤った解釈につながるリスクがあります。
また、臨床検査ラボや毒物検査ラボにとって、事件発生後に採取した血液検体を用いて、対象者が大麻の影響下にあったかどうかを判定できることが重要です。しかし、このような情報を得ることは、他の一般的な事件当時の検査と比べて容易ではありません。というのも、Δ9-THCは体内に取り込まれると急速に血中濃度が低下しますが、その代謝過程は非線形で個人差も大きいため、摂取時期や曝露時間を正確に推定することは困難です[1]。さらに、ヘビーユーザーの場合、最終接種から33日後にTHCが、また約30日後に尿からΔ9-THC-COOHが検出された例も報告されています。このため、これらの化合物は、検体採取時点で対象者が大麻の影響下にあるかどうかを判断する指標としては適していません[1,2]。Δ9-THCは体内に入ると酸化され、短命な中間代謝物である11-ヒドロキシ-Δ9-テトラヒドロカンナビノール(11-OH-Δ9-THC)となり、最終的にΔ9-THC-COOHに代謝されます。11-OH-Δ9-THC単独では、大麻の正確な摂取時期や曝露時間を正確に推定することはできませんが、この代謝物をモニタリングすることで、対象者が最近大麻を摂取した可能性を示す有力な手がかりとなります。
本研究では、2つの分析方法を開発しました。まず、尿中のΔ8-THCとΔ9-THCのカルボキシ代謝物(Δ9-THC-COOH/Δ8-THC-COOH)の両方をモニタリングする分析方法です。この方法は、2つの異性体間で十分な分離が得られるように設計されているので、異性体の一方が非常に高濃度で存在しても、定量データの信頼性と安定性は維持されます。次に開発したのは、親化合物(Δ8-THC/Δ9-THC)、ヒドロキシ代謝物(11-OH-Δ9-THC/11-OH-Δ8-THC)、カルボキシ代謝物(Δ9-THC-COOH/Δ8-THC-COOH)をモニタリングするための、全血を対象とした分析方法です。実験詳細とその結果と共に、各分析方法を詳説していきます。
実験
分析方法
1. 尿
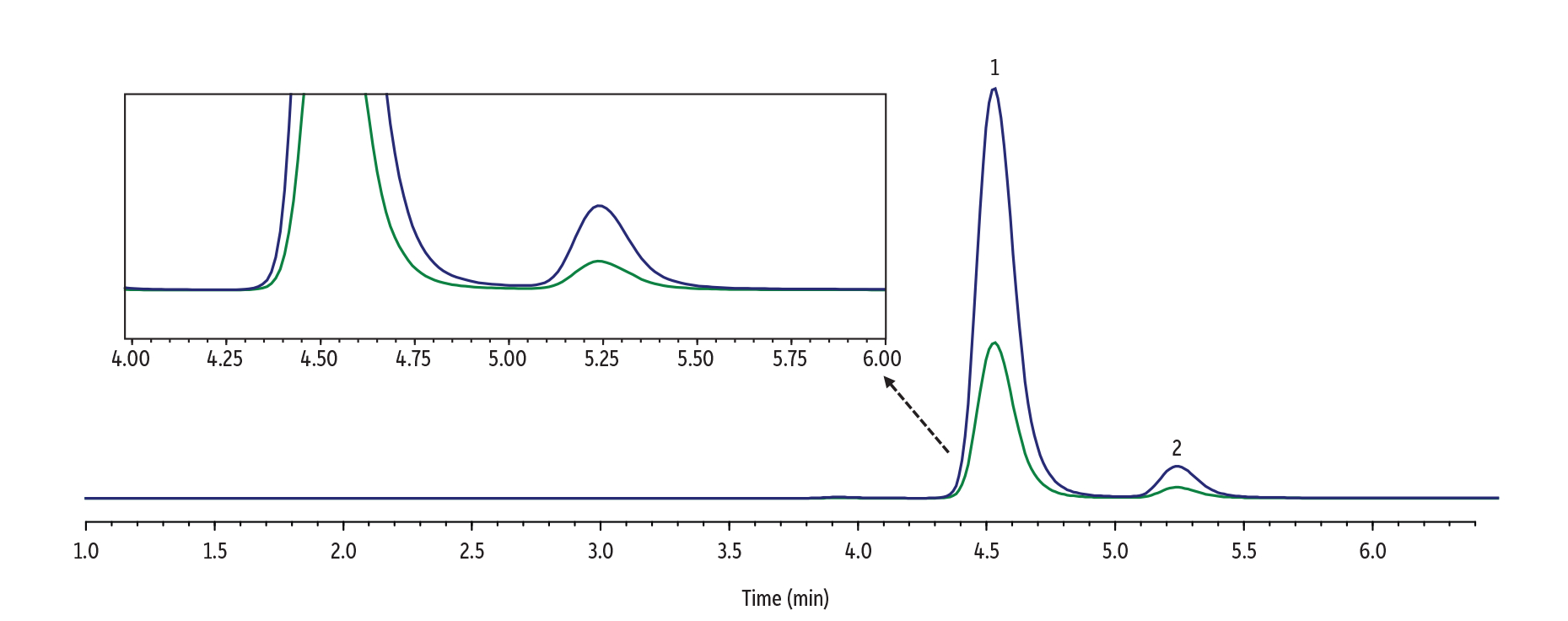
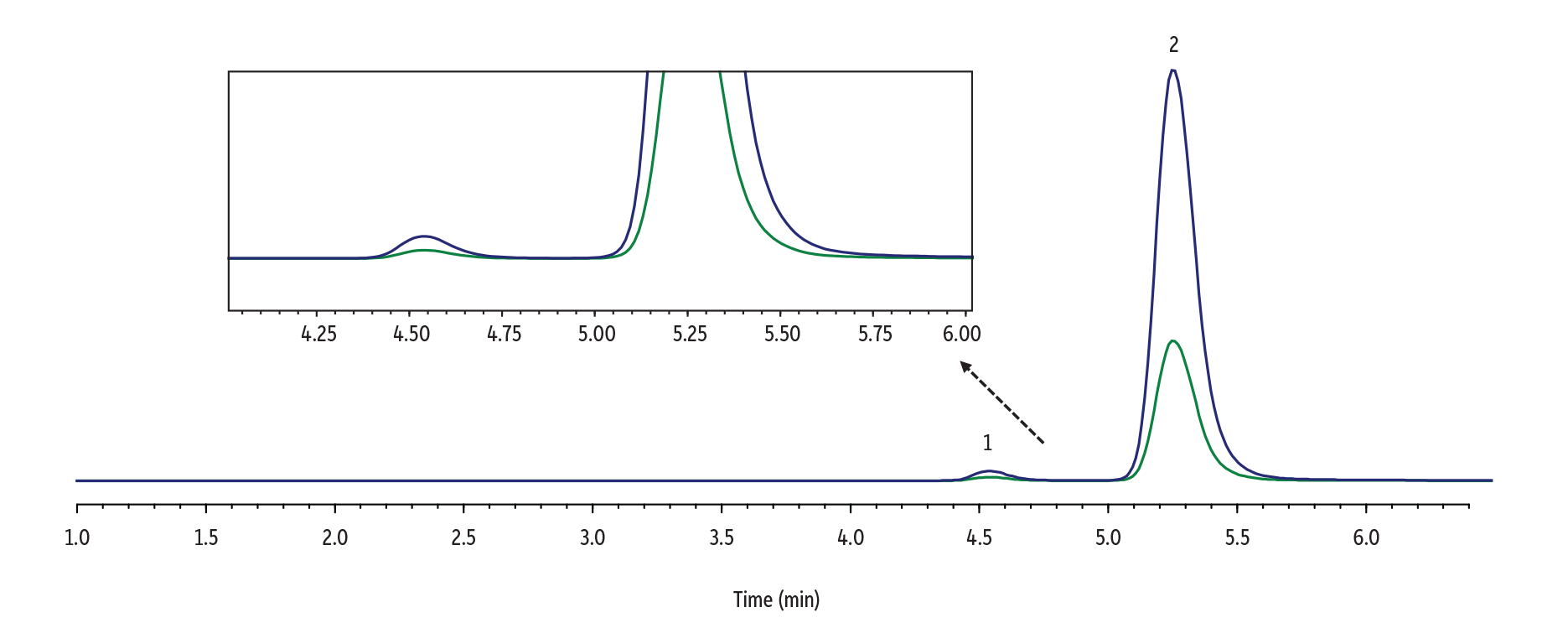
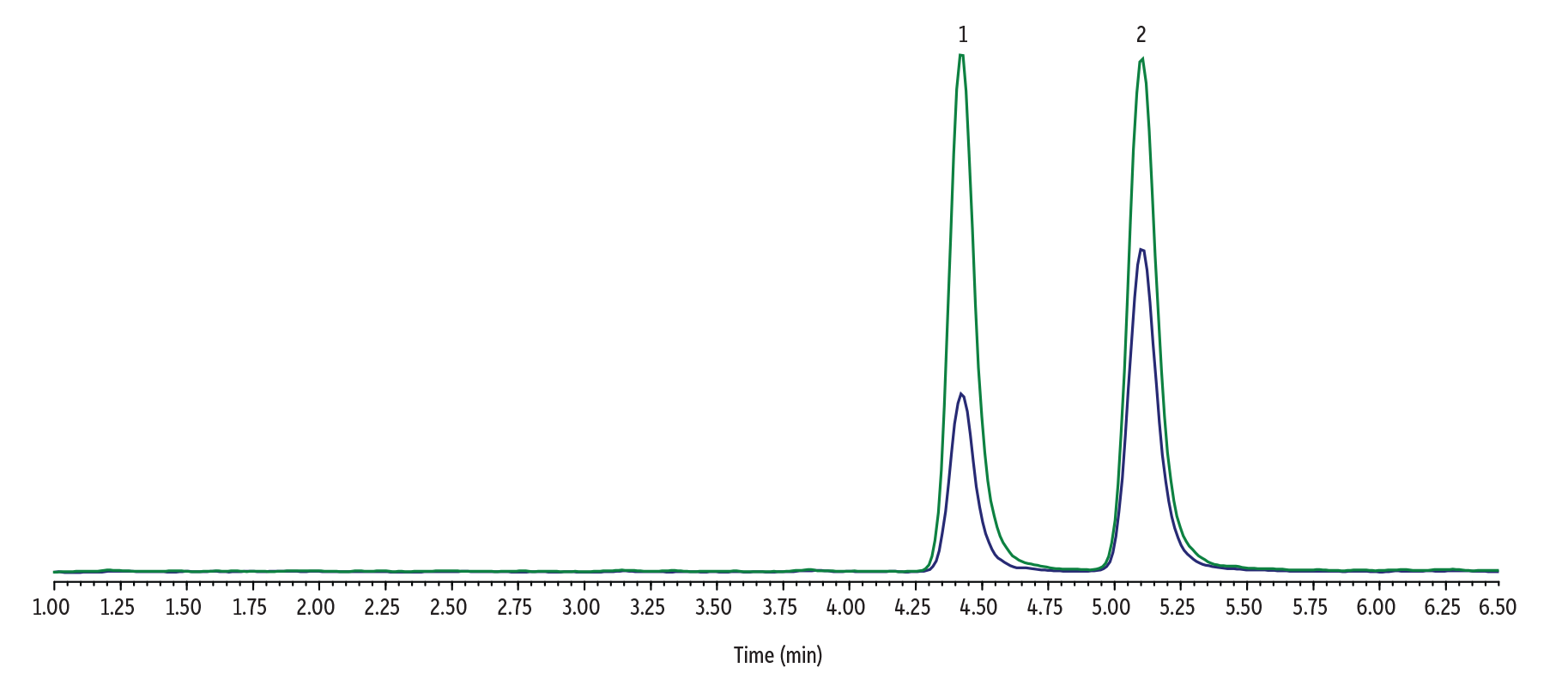
尿中のΔ8-THC-COOHおよびΔ9-THC-COOHを検出するための分析条件は以下の通りです。
LC_CF0828
Peaks
| Peaks | tR (min) | Precursor | Product 1 | Product 2 | |
|---|---|---|---|---|---|
| 1. | Δ8-THC-COOH | 4.44 | 345.1 | 327.0 | 299.2 |
| 2. | Δ9-THC-COOH | 5.12 | 345.1 | 327.0 | 299.2 |
2. 血液
全血中のΔ9-THC/Δ8-THC、Δ9-THC-COOH/Δ8-THC-COOH、11-OH-Δ9-THC/11-OH-Δ8-THCを検出するための分析条件は以下の通りです。
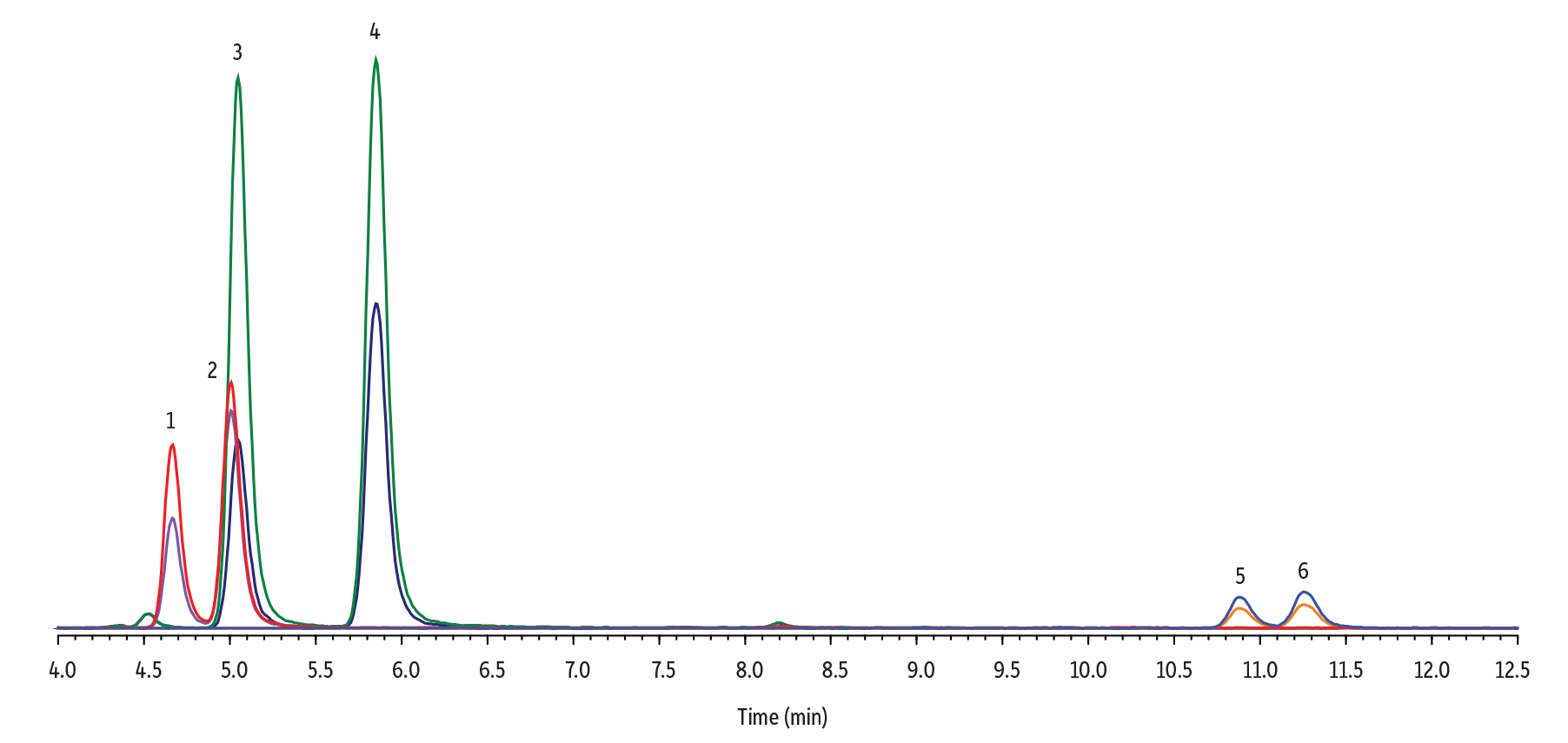
LC_CF0826
Peaks
| Peaks | tR (min) | Conc. (ng/mL) | Precursor | Product 1 | Product 2 | |
|---|---|---|---|---|---|---|
| 1. | 11-OH-Δ8-THC | 4.66 | 50 | 331.0 | 313.0 | 201.1 |
| 2. | 11-OH-Δ9-THC | 5.00 | 50 | 331.0 | 313.0 | 201.1 |
| 3. | Δ8-THC-COOH | 5.04 | 250 | 345.1 | 327.0 | 299.2 |
| 4. | Δ9-THC-COOH | 5.85 | 250 | 345.1 | 327.0 | 299.2 |
| 5. | Δ8-THC | 10.88 | 50 | 315.0 | 193.0 | 123.2 |
| 6. | Δ9-THC | 11.26 | 50 | 315.0 | 193.0 | 123.2 |
サンプル前処理
標準物質(コントロール)
校正用標準溶液、QC用標準溶液、内部標準物質はメタノールで調製しました。
1. 尿
尿校正用サンプルおよびQC用サンプルの前処理
ブランクのヒト尿にさまざまな濃度の標準物質を添加し、検量線範囲内でサンプルを調製しました。各サンプル500 μLをガラス製試験管に加え、内部標準物質(Δ9-THC-COOH-D9 濃度:1000ng/mL)50 μLを各サンプルに添加した後、ボルテックスしました。
加水分解尿QC用サンプルの前処理
グルクロニド陽性標準物質(Δ9-THC-COOH-グルクロニド)を750ng/mL(遊離時)の濃度になるようにブランク尿に添加し、サンプルを調製しました。サンプル500 μLをガラス製試験管に加え、内部標準物質(Δ9-THC-COOH-D9 濃度:1000ng/mL)50 μLをサンプルに添加した後、ボルテックスしました。
患者由来尿サンプルの前処理
患者から採取した尿サンプル500 μLをガラス製試験管に加え、内部標準物質(Δ9-THC-COOH-D9 濃度:1000ng/mL)50 μLをサンプルに添加した後、ボルテックスしました。
尿サンプルのアルカリ加水分解手順
THCは体内で代謝される過程でグルクロン酸抱合体として尿中に排泄されるため、正確な分析を行うには、尿検体を抽出する前の加水分解処理が不可欠です。本研究では、アルカリ加水分解でこの処理を行いました。まず、尿サンプル500 μLに、10N水酸化ナトリウム(NaOH)40 μLを添加しました。キャップされたサンプルをボルテックスした後、60℃で20分間保温(インキュベート)し、グルクロン酸抱合体を遊離型へと変換、保温完了後、冷却したサンプルに氷酢酸25 μLを添加し、pHを中和しました。この加水分解サンプル12 mLをガラス製試験管に移し、液液抽出(LLE)での抽出を行いました。
尿サンプルのLLE手順
HPLCグレードの水500 μLを各試験管に加え、ボルテックスしました。続いて各試験管に10%酢酸100 μLを添加し、再度ボルテックスし、ヘキサン:酢酸エチルを80:20で調製した溶液2.5 mLを各試験管に添加しました。その後、試験管にキャップをして、目視で混合が確認できるまでボルテックスしました。続いて、各サンプルを2800 rpmで15分間、または2つの層が完全に分離するまで遠心分離し、上清を清潔な試験管に移した後、サンプルを窒素下で乾固しました。乾固後、0.1%ギ酸を含む水:メタノールを40:60で調製した溶液100 µLでサンプルを再溶解し、ボルテックスしました。最後に、再溶解したサンプルをLCバイアルインサートに移し、LC-MS/MSによる分析を行いました。
2. 血液
血液校正用サンプルおよびQC用サンプルの前処理
ブランクのヒト血液(K2・EDTAを含む)にさまざまな濃度の標準物質を添加し、検量線範囲内でサンプルを調製しました。各サンプル500 μLをガラス製試験管に加え、内部標準物質(Δ9-THC-D3、11-OH-Δ9-THC-D3、Δ9-THC-COOH-D3 濃度:1000ng/mL)50 μLを各サンプルに添加した後、ボルテックスしました。
患者由来血液サンプルの前処理
患者から採取した血液サンプル500 μLをガラス製試験管に加え、内部標準物質(Δ9-THC-D3、11-OH-Δ9-THC-D3、Δ9-THC-COOH-D3 濃度:1000ng/mL)50 μLをサンプルに添加した後、ボルテックスしました。
血液サンプルのLLE手順
HPLCグレードの水500 μLを各試験管に加え、ボルテックスしたのち、10%酢酸100 μLを添加し、再度ボルテックスしました。ヘキサン:酢酸エチルを80:20で調製した溶液2.5 mLを各試験管に添加後、試験管にキャップをして、目視で混合が確認できるまで撹拌(ボルテックス)しました。次に、サンプルを2800rpmで15分間、または2つの層が完全に分離するまで遠心分離し、各サンプルの上清を清潔な試験管に移しました。その後、サンプルを窒素下で乾固し、0.1%ギ酸を含む、水:メタノールを40:60で調製した溶液100µLでサンプルを再溶解しました。最後に、再溶解したサンプルを撹拌(ボルテックス)してLCバイアルインサートに移し、LC-MS/MSによる分析を行いました。
結果と考察
1. 尿
クロマトグラフィー性能
Raptor FluoroPhenyl 2.7 µm, 100 x 3.0 mmカラムを用いた6.5分のイソクラティックグラジエント(総分析時間8.5分)で分析を行った結果、2つの異性体は良好に分離されました。このメソッドで得られた分離度は、尿サンプルにおいて時折見られる異性体の濃度に極端な差がある場合でも、2つの分析成分間の定量的な干渉を十分に防ぐことが示されました(Figure 3およびFigure 4参照)。
直線性
1/x 重み付け線形回帰を用いて直線性を確認したところ、すべての分析対象成分が、0.99以上の許容可能なr2値を示しており、優れた直線性が確認されました。Δ8-THC-COOHおよびΔ9-THC-COOHの校正範囲は濃度5~1000 ng/mL(尿検体中における典型的な濃度分布をカバー)に設定しました。また、マトリックス由来の干渉を確認するため、ブランク尿サンプル3検体を前処理して分析し、分析対象成分に由来しないシグナルの有無を確認しました。その結果、マトリックス由来の干渉は認められませんでした。また、もっとも高い校正濃度(1000 ng/mL)サンプルの注入後にメタノールブランクを注入し、キャリーオーバーについて確認したところ、キャリーオーバーは観察されませんでした。
再現性と精度
再現性と精度の評価は、LLOQ(定量下限)、Low QC(低濃度QC)、Medium QC(中濃度QC)、High QC(高濃度QC)の、4つの異なる濃度で実施しました。各濃度について、日内および3日間の測定(N=9)の平均値を用いて評価しました。メソッドの精度は、既知濃度に対する実測定量濃度のパーセンテージ(%)として定義され、日間再現性は相対標準偏差(%RSD)によって示しました。これらの結果より、本メソッドが、検討した濃度範囲において、高い精度と再現性を有していることが示されました(Table IおよびTable II参照)。
Table I: 尿サンプルにおけるメソッドの日間再現性に関する実験結果(%RSD)
| 分析対象成分 | LLOQ (5 ng/mL) | Low QC (25 ng/mL) | Med QC (250 ng/mL) | High QC (750 ng/mL) |
|---|---|---|---|---|
| Δ8-THC-COOH | 2.14% | 3.81% | 1.87% | 1.76% |
| Δ9-THC-COOH | 1.04% | 2.13% | 1.56% | 0.79% |
Table II: 尿サンプルにおけるメソッドの精度に関する実験結果(%R)
| 分析対象成分 | LLOQ (5 ng/mL) | Low QC (25 ng/mL) | Med QC (250 ng/mL) | High QC (750 ng/mL) |
|---|---|---|---|---|
| Δ8-THC-COOH | 83.0% | 94.7% | 93.6% | 96.3% |
| Δ9-THC-COOH | 80.6% | 98.1% | 90.5% | 95.2% |
2. 血液
クロマトグラフィー性能
Raptor FluoroPhenyl 2.7 µm, 100 x 3.0 mmカラム(cat.# 9319A1E)を用いた13分間のグラジエント分離(総分析時間16分)により、3組の異性体、計6種類の分析対象成分を良好に分離することができました。
直線性
1/x 重み付け線形回帰を用いて直線性を検証したところ、すべての分析対象成分において、0.99以上の許容可能なr2値を示し、優れた直線性が確認されました。11-OH-Δ8-THC、11-OH-Δ9-THC、Δ8-THC、Δ9-THの校正濃度範囲は0.5~100 ng/mLに、Δ8-THC-COOHおよびΔ9-THC-COOHは2.5~500 ng/mL(血液検体中における典型的な濃度分布をカバー)にそれぞれ設定しました。また、マトリックス由来の干渉を確認するために、ブランク血液サンプル3検体を前処理して分析し、分析対象成分に由来しないシグナルの有無を確認しましたが、マトリックス由来の干渉は認められませんでした。また、もっとも高い校正濃度(1000 ng/mLまたは500 ng/mL)サンプルの注入後にメタノールブランクを注入し、キャリーオーバーについて確認したところ、キャリーオーバーは観察されませんでした。
再現性と精度
再現性と精度の評価は、LLOQ(定量下限)、Low QC(低濃度QC)、Medium QC(中濃度QC)、High QC(高濃度QC)の、4つの異なる濃度で実施しました。各濃度について、日内および3日間の測定(N=9)の平均値を用いて評価しました。日間再現性は相対標準偏差(%RSD)としました。Table IIIおよびTable IVの結果から、本メソッドが、検討した濃度範囲において、高い精度と再現性を有していることが示されました。
Table III: 全血サンプルにおけるメソッドの日間標準偏差に関する実験結果(%RSD)
| 分析対象成分 | LLOQ (0.5/2.5 ng/mL) | Low QC (5/25 ng/mL) | Med QC (45/225 ng/mL) | High QC (75/375 ng/mL) |
|---|---|---|---|---|
| 11-OH-Δ8-THC | 6.73% | 6.12% | 3.65% | 3.44% |
| 11-OH-Δ9-THC | 9.90% | 4.13% | 3.61% | 3.37% |
| Δ8-THC-COOH* | 4.63% | 4.15% | 2.20% | 3.33% |
| Δ9-THC-COOH* | 4.04% | 2.13% | 1.78% | 2.74% |
| Δ8-THC | 11.4% | 7.77% | 8.89% | 6.95% |
| Δ9-THC | 9.32% | 4.00% | 1.56% | 2.23% |
*注:Δ-8/9-THC-COOHのターゲットQC濃度は5倍でした。
Table IV: 全血中サンプルにおけるメソッドの精度に関する実験結果(%)
| 分析対象成分 | LLOQ (0.5/2.5 ng/mL) | Low QC (5/25 ng/mL) | Med QC (45/225 ng/mL) | High QC (75/375 ng/mL) |
|---|---|---|---|---|
| 11-OH-Δ8-THC | 86.2% | 92.6% | 97.3% | 96.7% |
| 11-OH-Δ9-THC | 91.1% | 94.8% | 97.2% | 97.6% |
| Δ8-THC-COOH* | 96.8% | 96.0% | 97.1% | 97.2% |
| Δ9-THC-COOH* | 93.6% | 95.9% | 98.4% | 97.9% |
| Δ8-THC | 90.9% | 93.4% | 92.4% | 94.4% |
| Δ9-THC | 91.1% | 93.1% | 98.8% | 98.2% |
*注:Δ-8/9-THC-COOHのターゲットQC濃度は5倍でした。
分析対象成分間の相互干渉
同重体または構造的に類似した12種類のカンナビノイドによる干渉についても検討しました。具体的には、カンナビジバリン(CBDV);カンナビジオール(CBD);カンナビゲロール(CBG);テトラヒドロカンナビバリン(THCV);エキソテトラヒドロカンナビノール(エキソ-THC);9(S)-ヘキサヒドロカンナビノール(9(S)-HHC);カンナビシクロール(CBL)を含むサンプル; 9(R)-ヘキサヒドロカンナビノール(9(R)-HHC)カンナビノール(CBN);9(S)-Δ6a,10a-THC(Δ10-THC);カンナビクロメン(CBC);およびテトラヒドロカンナビノール酸A(THCA-A)を含むサンプルを調製し、開発した分析方法で評価したところ、モニタリングされた全ての化合物は分析対象成分から良好に分離されていることが確認されました。特に、CBLはΔ9-THCと同じMRMウィンドウで溶出しますが、保持時間に明確な差があるため(11.16分と11.40分)、誤同定のリスクは極めて低いと考えられます。以上の結果から、本メソッドではこれら類似カンナビノイドによる分析対象成分への干渉は認められず、高い選択性が確認されました(Figure 5参照)。
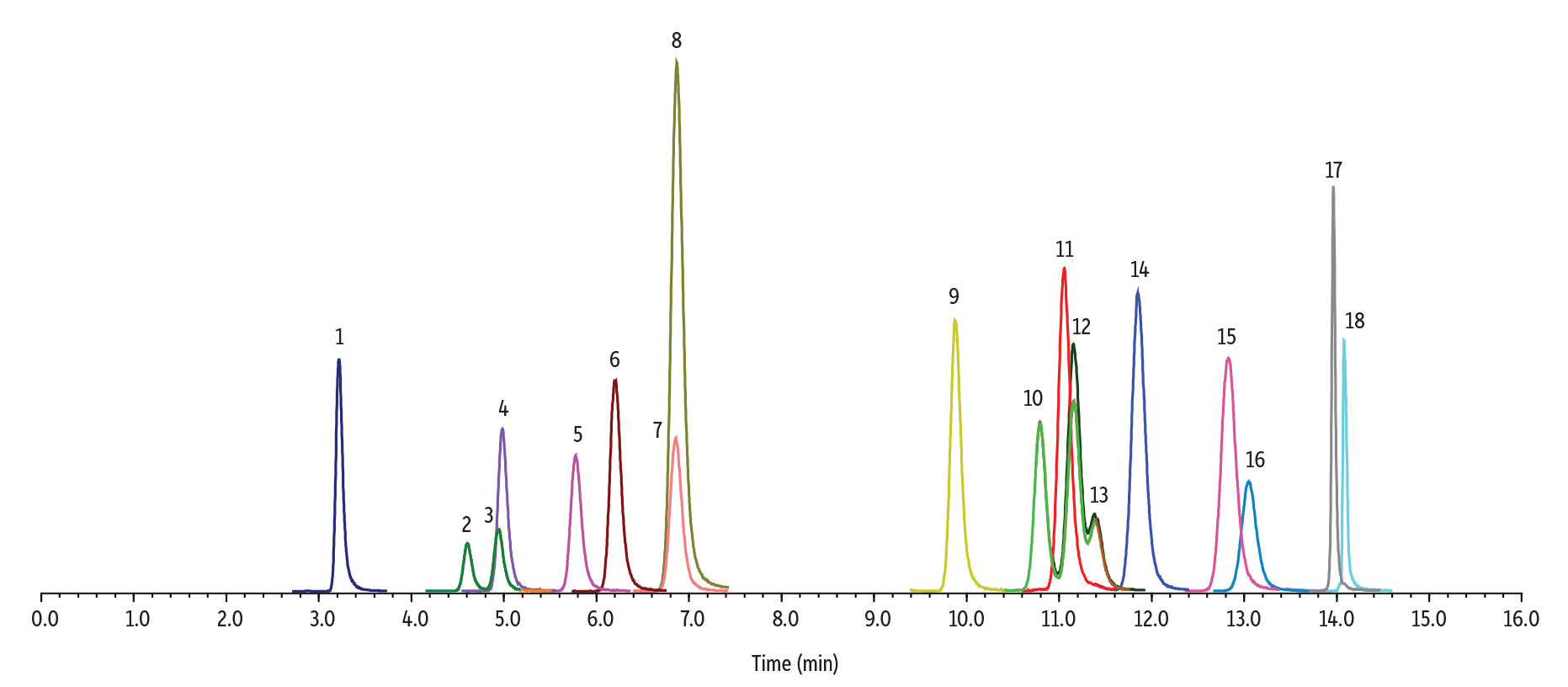
LC_CF0827
Peaks
| Peaks | tR (min) | Precursor | Product 1 | Product 2 | |
|---|---|---|---|---|---|
| 1. | CBDV | 3.22 | 286.9 | 165.1 | 122.9 |
| 2. | 11-OH-Δ8-THC | 4.60 | 331.0 | 313.0 | 201.1 |
| 3. | 11-OH-Δ8-THC | 4.94 | 331.0 | 313.0 | 201.1 |
| 4. | Δ8-THC-COOH | 4.98 | 345.1 | 327.0 | 299.2 |
| 5. | Δ8-THC-COOH | 5.77 | 345.1 | 327.0 | 299.2 |
| 6. | CBD | 6.20 | 315.0 | 193.0 | 123.2 |
| 7. | THCV | 6.85 | 286.9 | 165.1 | 122.9 |
| 8. | CBG | 6.87 | 317.0 | 193.1 | 123.0 |
| 9. | exo-THC | 9.88 | 315.0 | 193.0 | 123.2 |
| Peaks | tR (min) | Precursor | Product 1 | Product 2 | |
|---|---|---|---|---|---|
| 10. | Δ8-THC | 10.80 | 315.0 | 193.0 | 123.2 |
| 11. | 9(S)-HHC | 11.05 | 317.0 | 193.0 | 123.1 |
| 12. | Δ9-THC | 11.16 | 315.0 | 193.0 | 123.2 |
| 13. | CBL | 11.40 | 315.0 | 193.0 | 123.2 |
| 14. | 9(R)-HHC | 11.85 | 317.0 | 193.0 | 123.1 |
| 15. | CBN | 12.82 | 311.1 | 223.0 | 293.2 |
| 16. | Δ10-THC | 13.05 | 315.0 | 193.0 | 259.2 |
| 17. | CBC | 13.96 | 315.0 | 193.0 | 123.2 |
| 18. | THCA-A | 14.08 | 359.3 | 341.2 | 219.0 |
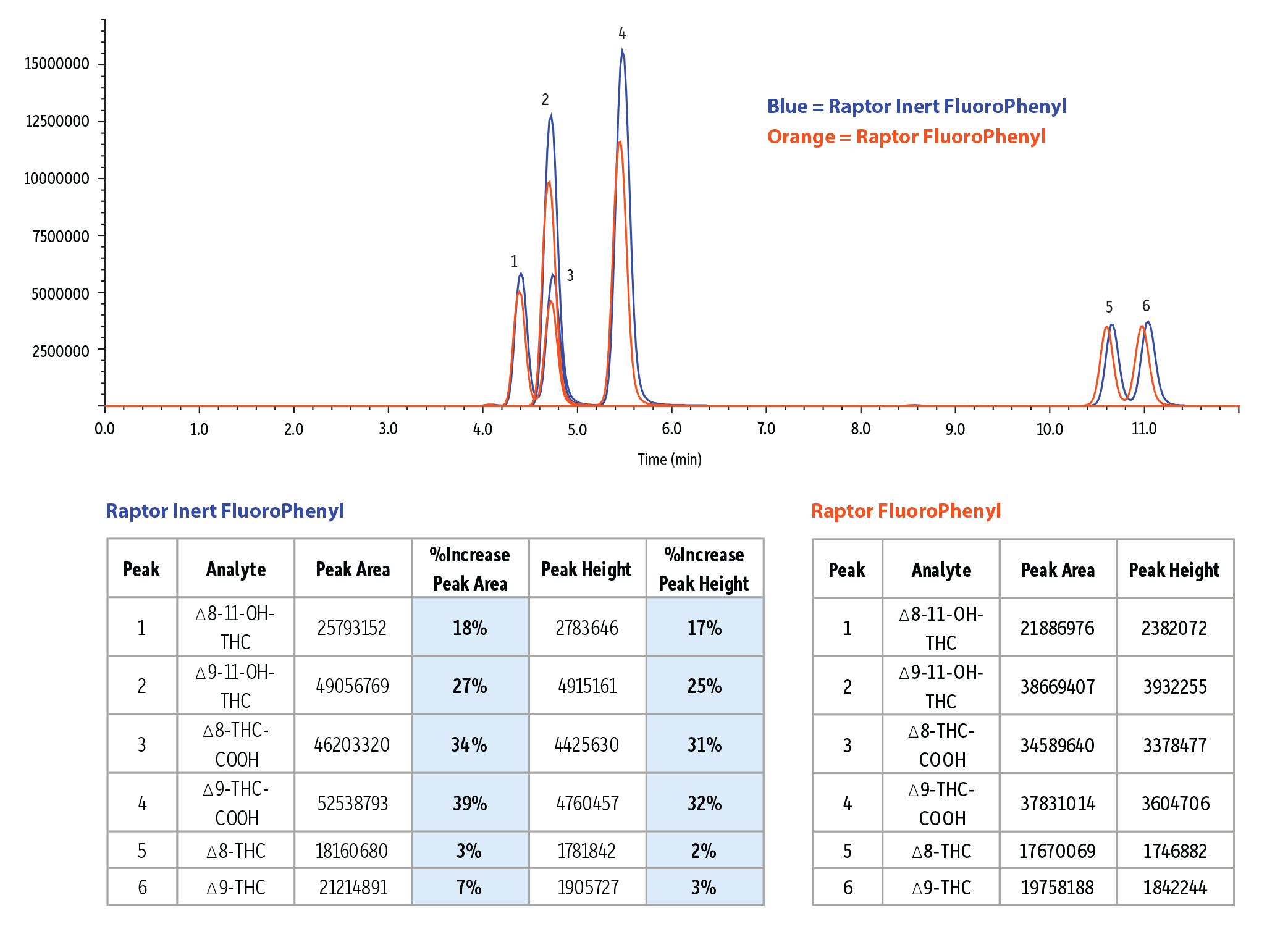
イナートカラムの利点
不活性処理されたHPLCカラムは従来のステンレスカラムに比べて多くの利点があります。Restekのイナートカラムには、カラム内部のステンレス鋼表面に高度な不活性コーティングが施されています。これによって、金属表面全体に広く分析成分が吸着せず、キレート化が大幅に抑制されます。酸性化合物はキレート化しやすいため、ピーク形状悪化、検出感度低下の傾向がありますが、Restekのイナートカラムによってこれらの改善が期待できます。実際の比較試験では、Raptor FluoroPhenylカラム(従来型)とRaptorイナートカラムを用いて分析を行ったところ(Figure 6参照)、親化合物については両カラム間で大きな違いは見られませんでした。しかし、ヒドロキシ化合物やカルボキシ化合物では、イナートカラムを使用することでピーク面積とピーク高さが明らかに増加し、検出感度が向上しました。このように、イナートHPLCカラムは、従来のステンレスカラムでは困難だった分析成分(ヒドロキシおよびカルボキシ)の分析を可能にし、ラボの分析精度と効率を大きく向上させます。
結論
ヒト尿中および全血中のTHC異性体を信頼性高く正しく測定するための2つの革新的な分析方法を開発しました。また、各メソッドにおいて、全血および尿の両方のマトリックスに対して、簡便な液液抽出法を適用しました[3,4]。尿分析においては、THCのカルボキシル代謝物を異性体間で完全に分離可能なLC-MS/MSメソッドを開発しました。これにより、Δ8-THCとΔ9-THCなど、類似構造を持つ異性体の定性を明確に行い、正確な定量報告が可能となりました。次に、全血マトリックスでは、事件発生時の被験者の中毒状態評価を目的として、親化合物、ヒドロキシ代謝物、カルボキシル代謝物をモニタリングする方法を構築しました。これらの手法は、高速で堅牢かつ高感度であることも確認されており、事件発生時の正確な診断やΔ8-THCとΔ9-THCの摂取識別に従事している臨床検査ラボや毒物検査ラボにとって、極めて有用なソリューションとなることが示されました。
参考文献
- E.L. Karschner, M.J. Swortwood-Gates, M.A. Huestis, Identifying and Quantifying Cannabinoids in Biological Matrices in the Medical and Legal Cannabis Era. Clinical Chemistry 66 (7) (2020) 888-914. https://academic.oup.com/clinchem/article/66/7/888/5867829?login=false
- Mayo Clinic Laboratories, Marijuana: Comprehensive urine drug testing to confirm and monitor use https://www.mayocliniclabs.com/test-catalog/drug-book/specific-drug-groups/marijuana (Accessed April 1, 2025).
- Virginia Department of Forensic Science, Toxicology Procedures Manual, 2024, https://dfs.virginia.gov/wp-content/uploads/220-D100%20Toxicology%20Procedures%20Manual-2816-67ec03f17b822.pdf
- N.B. Tiscione, R . Miller, X. Shan, J. Sprague, D.T. Yeatman. An efficient, robust method for the determination of cannabinoids in whole blood by LC-MS-MS. J Anal. Toxicol., 40 (2016) (8) 639-648. https://doi.org/10.1093/jat/bkw063
このメソッドは研究用途のみに開発されており、診断に使用するにはさらなる検証が必要です。