概要
乱用薬物の検査は、毒物学や職場での薬物スクリーニングなど、さまざまな分野で重要な役割を果たしています。従来は血液や尿が標準的な検体として用いられてきましたが、これらの採取は身体への負担が大きく、被験者にとってもストレスとなる場合があります。こうした背景から、近年は口腔液(唾液)を用いた検査が注目されています。口腔液は、簡単な方法で被験者にストレスを与えず採取可能であることから、より多くの現場で利用が広がっています。一方で、口腔液検査には課題もあります。特に、採取に用いる装置の緩衝液には保存料や界面活性剤といった添加剤が含まれており、これらが分析に干渉する可能性があります。そのため、これらの成分を除去する前処理として固相抽出(SPE)工程が必要ですが、この工程には現状、多くの時間と手間がかかっているのが実情です。そこで、今回の研究では、LC-MS/MSを用いた口腔液中の乱用薬物および新規精神活性物質の分析において、塩析支援液液抽出(SALLE)、保持型液液抽出(SLE)、および希釈注入という3つのサンプル前処理技術を比較し、SPE工程の時間短縮を目指しました。
はじめに
簡便かつ被験者にストレスを与えずに採取可能なため、より多くの現場で利用が広がる口腔液検査[1]ですが、口腔液は、唾液そのものだけでなく、口腔内の細菌や食べかすなども含む複雑なマトリックスです[2]。血液と良好な薬物濃度の相関が得られる一方で、飲食や喫煙など、採取前の生活習慣が検査結果に影響を与える点には注意が必要です[1]。また、尿検査で懸念されるような、検体への異物混入(不純物)や水などによる希釈、他人の尿とすり替えるといった不正のリスクが比較的少ないことも、口腔液検査の利点のひとつです[1,2]。
口腔液を用いた薬物分析では、通常、固相抽出(SPE)や希釈注入法がサンプル前処理として用いられます。口腔液自体は比較的作業しやすいマトリックスですが、採取キットの緩衝液に含まれる添加剤が問題です。緩衝液はサンプル保存と微生物の増殖抑制に必要なものですが、緩衝液に含まれる添加剤はマトリックス効果を引き起こし、分析カラムの寿命を縮めることがあります。SPEの方が緩衝液の影響を軽減できますが、手順が複雑で時間がかかるというデメリットもあります。
実際に薬物分析を行うラボが求めるのは時間がかからない、効果的なサンプル前処理です。そこで、この実験では、保持型液液抽出(SLE)と塩析支援液液抽出(SALLE)および、単純な希釈注入法という3種類のサンプル前処理について比較を行いました。なお、希釈注入法では検出感度が著しく低く、定量的評価が困難だったため、以降の検討対象から除外しました。一方、SLEおよびSALLEを採用したサンプルでは良好なレスポンスが得られ、精度、再現性、直線性の結果は良好で、有用性があると評価されました。
実験
校正用標準試料と品質管理(QC)用標準試料の調製
【校正用標準溶液】
10,000, 5000, 2500, 1000, 500, 100, 50, 20 ng/mLの濃度になるように、10,000 ng/mLの標準溶液をメタノールで希釈し、調製
【品質管理(QC)用標準溶液】
50, 650, 1500, 6500 ng/mLの濃度になるように、10,000 ng/mLの標準溶液をメタノールで希釈し、調製
【内部標準物質】
Table Iに示した分析成分を使用して、100 ng/mLの濃度になるように調製
上記の方法で調製した各標準溶液100 µLを合成口腔液(UTAK社製)900 µLに加えて10倍に希釈し、校正用およびQC用の標準試料を作製しました。その後、下記のサンプル前処理を実施しました。
Table I: 内部標準物質およびMRMトランジション
| 内部標準物質 | Precursor Ion | Product Ion 1 |
|---|---|---|
| Methamphetamine-D5 | 155.6 | 92.1 |
| Norfentanyl-D5 | 238.6 | 55.2 |
| Oxazepam-D5 | 292.3 | 246.1 |
| LSD-D3 | 327.2 | 179.9 |
| MDMA-D5 | 199.1 | 107.1 |
| Ketamine-D4 | 242.5 | 129.1 |
| 7-Aminoclonazepam-D4 | 290.4 | 121.0 |
| 6-Acetylmorphine-D3 | 331.3 | 165.0 |
| PCP-D5 | 249.4 | 96.2 |
| Fentanyl-D5 | 342.2 | 105.0 |
| EDDP-D3 | 280.7 | 234.2 |
| Hydromorphone-D3 | 289.1 | 184.9 |
| Methadone-D3 | 313.1 | 105.1 |
| Buprenorphine-D4 | 471.9 | 243.2 |
| Temazepam-D5 | 306.3 | 260.0 |
| Norbuprenorphine-D4 | 417.6 | 186.9 |
| Morphine-D3 | 289.6 | 164.9 |
| Oxycodone-D6 | 322.4 | 247.1 |
| Oxymorphone-D3 | 305.4 | 230.1 |
| Nordiazepam-D5 | 276.3 | 140.1 |
| Alprazolam-D5 | 314.2 | 286.0 |
| Isotonitazene-D7 | 418.2 | 100.0 |
| Cocaine-D3 | 307.3 | 185.3 |
| Lidocaine-D10 | 245.2 | 64.0 |
| delta-9-THC-D3 | 318.2 | 193.1 |
| Gabapentin-D10 | 182.0 | 147.2 |
サンプル前処理法
1. 希釈注入法
◦ 実際の濃度に近い濃度でシミュレーションを行うために校正用標準試料およびQC用標準試料、各1 mLにQuantisal緩衝液(Immunalysis社製)3 mLを添加
◦ この緩衝液添加済みの標準試料それぞれ100 µLを2 mL容量の微量遠心チューブに入れた後、内部標準物質20 µLを添加し、10秒間撹拌(以降この状態をサンプルとする)
◦ 各サンプルに、0.1%ギ酸水溶液:0.1%ギ酸メタノール溶液を90:10で調製した溶液460 µLを添加し、再度撹拌
◦ インサート付きのLCバイアル(2.0 mL褐色ショートキャップバイアル:cat.# 21142、50 µLインサート:cat.# 24513)に試料を移し、9 mmショートスクリューキャップ(cat.# 24497)で密封後、LC-MS/MSで分析した。
2. 保持型液液抽出(SLE)
◦ 実際の濃度に近い濃度でシミュレーションを行うために校正用標準試料およびQC用標準試料、各1 mLにQuantisal緩衝液(Immunalysis社製)3 mLを添加
◦ この緩衝液添加済みの標準試料それぞれ100 µLを2 mL容量の微量遠心チューブに入れた後、5%水酸化アンモニウム100 µLと内部標準物質20 µLを添加し、撹拌(以降この状態をサンプルとする)
◦ 各サンプル200 µLを200 mg容量のResprep SLEカートリッジ(cat.# 28302)に充填(ハイスループットな分析には、Resprep SLE96ウェルプレート(cat.# 28304)が使用可能)
◦ 充填剤に各サンプルが保持されるように、最初の数秒間は軽い真空状態にし、その後の5分間、各サンプルを充填剤に保持させた後、ジクロロメタン:イソプロパノールを95:5で調製した溶液500 µLにそれぞれ溶解させる
◦ 各サンプルを蒸発乾固した後、0.1%ギ酸水溶液:0.1%ギ酸メタノール溶液を90:10で調製した溶液100 µLに再溶解させ、撹拌
◦ インサート付きのLCバイアル(2.0 mL褐色ショートキャップバイアル:cat.# 21142、50 µLインサート:cat.# 24513)に試料を移し、9 mmショートスクリューキャップ(cat.# 24497)で密封後、LC-MS/MSで分析した。
3. 塩析支援液液抽出(SALLE)
◦ 実際の濃度に近い濃度でシミュレーションを行うために校正用標準試料およびQC用標準試料、各1 mLにQuantisal緩衝液(Immunalysis社製)3 mLを添加
◦ この緩衝液添加済みの標準試料それぞれ100 µLを2 mL容量の微量遠心チューブに入れた後、内部標準物質20 µLを添加し、10秒間撹拌(以降この状態をサンプルとする)
◦ 各サンプルが入っているチューブに、飽和NaCl溶液100 µLを入れた後、アセトニトリル280 µLを添加し、再度10秒間撹拌後、3700 rpmで10分間遠心分離を実施
◦ 有機層200 µLを試験管に水溶液として採取し、窒素下で蒸発乾固
◦ 各サンプルに、0.1%ギ酸水溶液:0.1%ギ酸メタノール溶液を90:10で調製した溶液50 µLを添加し、再度撹拌
◦ インサート付きのLCバイアル(2.0 mL褐色ショートキャップバイアル:cat.# 21142、50 µLインサート:cat.# 24513)に試料を移し、9 mmショートスクリューキャップ(cat.# 24497)で密封後、LC-MS/MSで分析した。
サンプル採取キットからの回収量検証
実際にQuantisalキットを使用した際の、サンプル回収量を確認するテストを実施しました。まず、キット内のスポンジを、合成口腔液のブランクサンプル1 mL(150 ng/mLの濃度になるように添加済み)に浸しました。次に、この1 mLをすべて吸収したスポンジを緩衝液に浸し、冷蔵庫で一晩保管し、その後、SALLEと同様のワークフローで処理しました。このようにして、スポンジからのサンプル回収方法(手動圧搾 vs. 遠心分離)による回収量や分析成分の回収率への影響も検証しました。
分析条件
口腔液サンプルを用いた乱用薬物分析を以下の条件で行いました。各化合物のモニタリングされたイオンはTable IIを参照してください。
分析装置 : 島津 Nexera X2 LC (検出器:SCIEX 4500 MS/MS)
分析カラム : Raptor Biphenyl 2.7 µm, 50 mm x 2.1 mm (cat.# 9309A52)
ガードカラム: Raptor Biphenyl EXP ガードカラムカートリッジ 5 x 2.1 mm, 2.7 µm (cat # 9309A0252)
移動相A: 0.1% ギ酸水溶液
移動相B: 0.1% ギ酸メタノール溶液
グラジエント:15% B (0分) → 20% B (1.00分) → 20% B (2.00分) → 50% B (4.00分)→ 60% B (6.00分)→ 100% B (8.00分) → 100% B (9.00分) → 15% B (9.01分) → 15% B (10.00分)
流速: 0.5 mL/min
注入量: 5 µL
カラム温度: 40 °C
イオン化モード: Positive ESI
Table II: ターゲット乱用薬物とLC-MS/MS分析でモニタリングされた各イオン
| ターゲット成分 | tR | Precursor Ion | Product Ion 1 | Product Ion 2 |
|---|---|---|---|---|
| Morphine | 0.82 | 286.10 | 152.10 | 165.00 |
| Pregabalin | 0.88 | 160.18 | 55 | 97.1 |
| Oxymorphone | 0.92 | 302.14 | 227.20 | 198.20 |
| Cathinone | 0.94 | 149.90 | 132.90 | 106.20 |
| Amphetamine | 1.18 | 136.22 | 91.00 | 65.10 |
| Hydromorphone | 1.22 | 286.16 | 184.90 | 156.90 |
| Gabapentin | 1.22 | 172.20 | 154.00 | 137.10 |
| Methcathinone | 1.33 | 164.50 | 146.15 | 131.20 |
| MDA | 1.50 | 180.13 | 163.10 | 105.20 |
| Methamphetamine | 1.53 | 150.25 | 91.10 | 119.00 |
| Phentermine | 1.78 | 150.24 | 91.10 | 133.10 |
| Methylone | 1.80 | 207.90 | 159.90 | 189.90 |
| Lidocaine | 1.83 | 235.40 | 86.00 | 58.20 |
| Naloxone | 1.90 | 328.27 | 310.10 | 212.10 |
| Dihydrocodeine | 2.09 | 302.20 | 199.00 | 128.20 |
| MDMA | 2.15 | 194.17 | 163.00 | 105.1 |
| Codeine | 2.22 | 300.16 | 152.00 | 165.10 |
| 6-Acetylmorphine | 2.38 | 328.30 | 164.90 | 211.10 |
| Levamisole | 2.59 | 205.08 | 178.00 | 91.10 |
| Oxycodone | 2.69 | 316.19 | 298.00 | 169.00 |
| Naltrexone | 2.85 | 342.19 | 324.00 | 267.00 |
| MDEA | 2.92 | 208.13 | 163.00 | 105.20 |
| Hydrocodone | 2.98 | 300.14 | 199.00 | 128.00 |
| Norketamine | 3.30 | 224.08 | 125.00 | 89.10 |
| Eutylone | 3.39 | 236.10 | 188.05 | 218.15 |
| Norfentanyl | 3.55 | 233.13 | 84.10 | 55.00 |
| 4-Hydroxy nitazene | 3.70 | 369.10 | 100.20 | 72.20 |
| Pentylone | 3.73 | 236.10 | 188.05 | 218.15 |
| Dextrorphan | 3.78 | 258.15 | 157.00 | 201.20 |
| Xylazine | 3.85 | 221.90 | 90.10 | 71.90 |
| Ketamine | 3.90 | 238.07 | 125.10 | 89.10 |
| Benzoylecgonine | 4.00 | 290.13 | 168.10 | 77.10 |
| Meperidine | 4.03 | 248.14 | 220.10 | 174.10 |
| 7-Aminoclonazepam | 4.05 | 286.08 | 121.20 | 250.10 |
| Cocaine | 4.28 | 304.18 | 182.00 | 77.10 |
| 7-Hydroxymitragynine | 4.50 | 415.60 | 189.90 | 175.00 |
| Cocaethylene | 4.60 | 318.21 | 196.10 | 82.00 |
| LSD | 4.60 | 324.27 | 223.10 | 208.00 |
| Norbuprenorphine | 4.65 | 414.30 | 250.10 | 187.10 |
| Chlordiazepoxide | 4.74 | 300.10 | 282.00 | 227.00 |
| Acetyl fentanyl | 4.75 | 323.28 | 188.00 | 105.00 |
| Zolpidem | 4.80 | 308.21 | 235.20 | 218.90 |
| Fentanyl | 5.15 | 337.29 | 188.00 | 105.10 |
| Dextromethorphan | 5.17 | 272.19 | 215.10 | 170.90 |
| Isotonitazene | 5.18 | 411.00 | 100.20 | 72.15 |
| PCP | 5.20 | 244.15 | 86.10 | 159.10 |
| Buprenorphine | 5.20 | 468.30 | 396.20 | 414.20 |
| Midazolam | 5.22 | 326.19 | 291.10 | 248.90 |
| Propoxyphene | 5.33 | 340.27 | 265.90 | 58.10 |
| Tianeptine | 5.38 | 437.90 | 293.20 | 229.10 |
| Protonitazene | 5.49 | 411.00 | 100.30 | 72.15 |
| Sufentanil | 5.62 | 387.23 | 111.10 | 234.30 |
| EDDP | 5.62 | 278.15 | 234.30 | 249.20 |
| Mitragynine | 5.78 | 399.25 | 159.00 | 153.90 |
| iso-Butonitazene | 6.10 | 425.00 | 100.30 | 72.20 |
| Methadone | 6.25 | 310.20 | 264.90 | 105.10 |
| Lorazepam | 6.35 | 321.05 | 275.00 | 229.00 |
| Oxazepam | 6.40 | 287.07 | 268.80 | 241.20 |
| Clonazepam | 6.50 | 316.09 | 270.00 | 214.10 |
| Nordiazepam | 6.80 | 271.00 | 139.90 | 164.90 |
| Clonazolam | 6.83 | 354.10 | 308.10 | 279.80 |
| Alprazolam | 7.28 | 309.11 | 280.90 | 204.90 |
| Temazepam | 7.30 | 301.11 | 255.10 | 282.90 |
| Bromazolam | 7.40 | 353.10 | 325.20 | 218.00 |
| Etizolam | 7.52 | 343.10 | 314.00 | 258.90 |
| Diazepam | 7.59 | 285.07 | 153.90 | 192.90 |
| Cannabidiol | 7.85 | 315.20 | 193.00 | 123.20 |
| Delta-9-THC | 8.10 | 315.50 | 193.10 | 259.10 |
結果と考察
SLEにおける最適な溶出溶媒の選定
サンプル前処理にSLEを採用するメソッドでは、分析成分の極性は多岐にわたり、その量も多くなります。したがって、適切に分析成分を溶出させる溶出溶媒の選定が重要になってきます。そこで、最適な溶出溶媒を選定するために、7種類の溶出溶媒を比較するテストを実施しました。テストした溶媒は、メタノール、アセトニトリル、ジクロロメタン、ヘキサン、50:50 ジクロロメタン:酢酸エチル、95:5 ジクロロメタン:イソプロパノール、95:5 ジクロロメタン:メタノールです。低濃度と高濃度のサンプルでテストされ、すべての分析成分についてピーク形状、ピーク面積、ピーク高さを比較した結果、95:5 ジクロロメタン:イソプロパノールが最も多くの分析成分で良好なピーク形状と感度を示したため、最適な溶媒として選定されました。
サンプル前処理法の比較
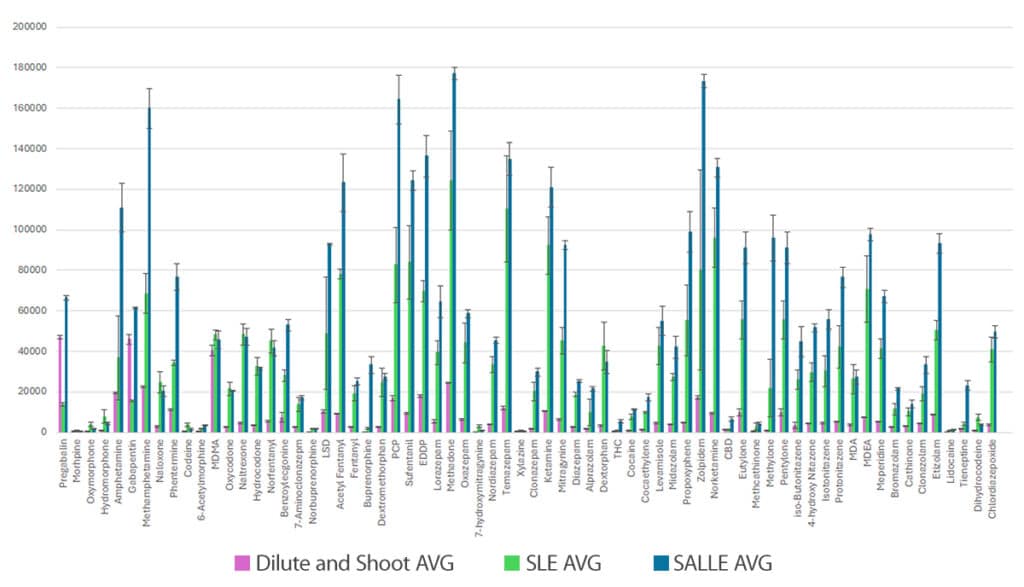
サンプル前処理にSLEおよびSALLEを採用した結果、希釈注入法と比較して、ほとんどの分析成分でレスポンスが大幅に向上しました。
SLEは、特性が類似する分析成分を含むサンプルから緩衝液を除去するのに有効でした。一方、SALLEは、さまざまな特性を持つ薬物に含まれる化合物全般に対して良好な結果を示しました。本ワークフローにおけるSLEによる前処理では、多くのオピエートでレスポンスが向上しました。しかし、プレガバリン、ガバペンチン、THC、CBDについてはレスポンスが極めて低く、許容できる水準には達しませんでした。したがって、これらの成分についてはSLEワークフローでの精度および再現性の評価を行っていません。
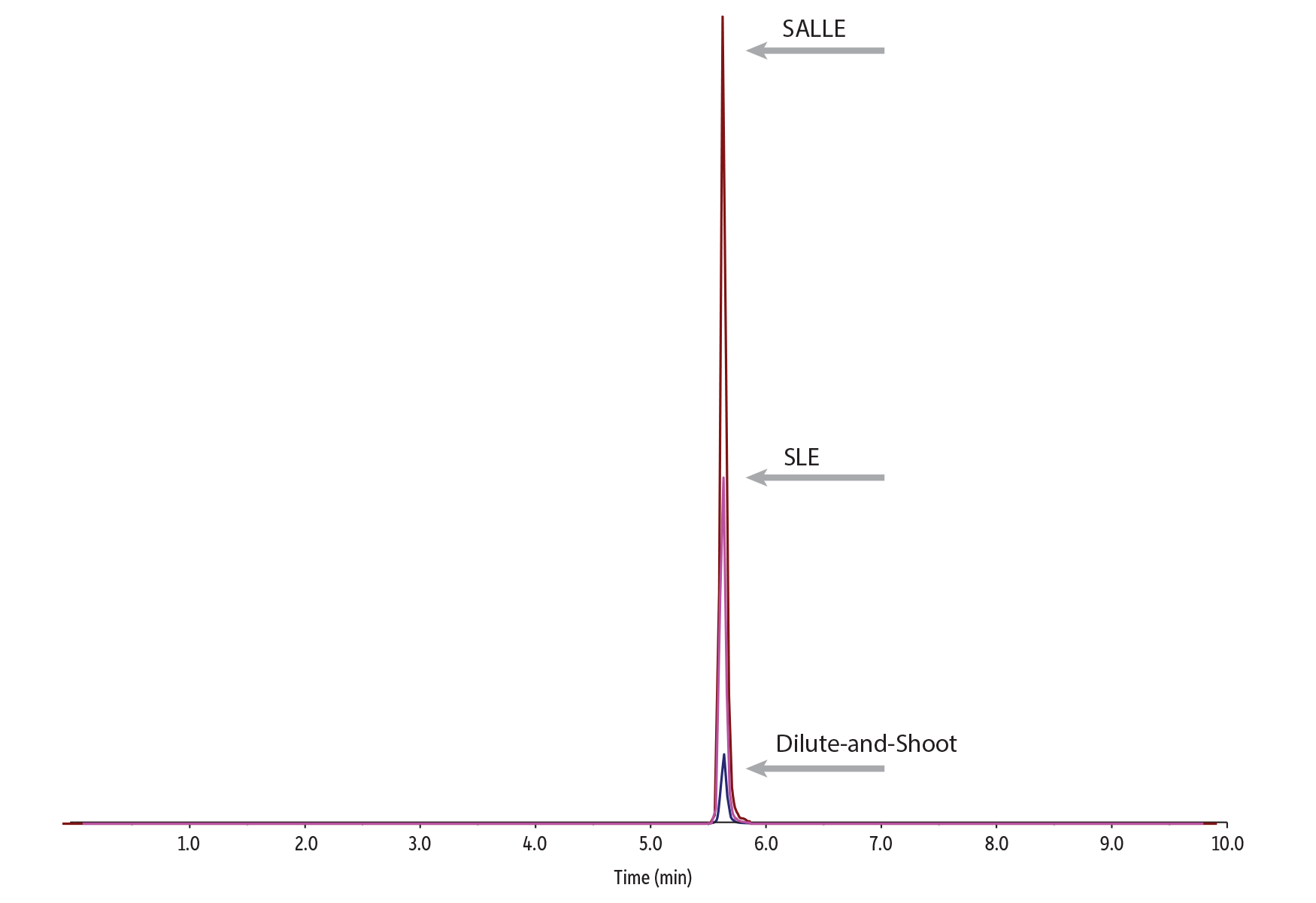
Figure 1には、SLE、SALLE、希釈注入法という3種類の前処理を行った各サンプル(濃度10 ng/mL)のピーク面積レスポンスを示しています。
エラーバーは標準偏差を表します。
SALLEやSLEが希釈注入法よりも優れたパフォーマンスを示すのは、ミトラギニンとノルフェンタニルのピークレスポンスを比較した以下の結果からも分かります。ミトラギニンはSALLEを使用した場合に最も高いレスポンスを示し (Figure 2)、ノルフェンタニルはSLEを使用した場合に高いレスポンスを示しました (Figure 3)。この例が明示しているのは、分析成分によって最も効果的なサンプル前処理は異なる、ということです。どの前処理法を選択するか決定する際には、分析成分リストとLOQの要件を慎重に考慮すべきでしょう。
サンプル採取キットからの回収量検証
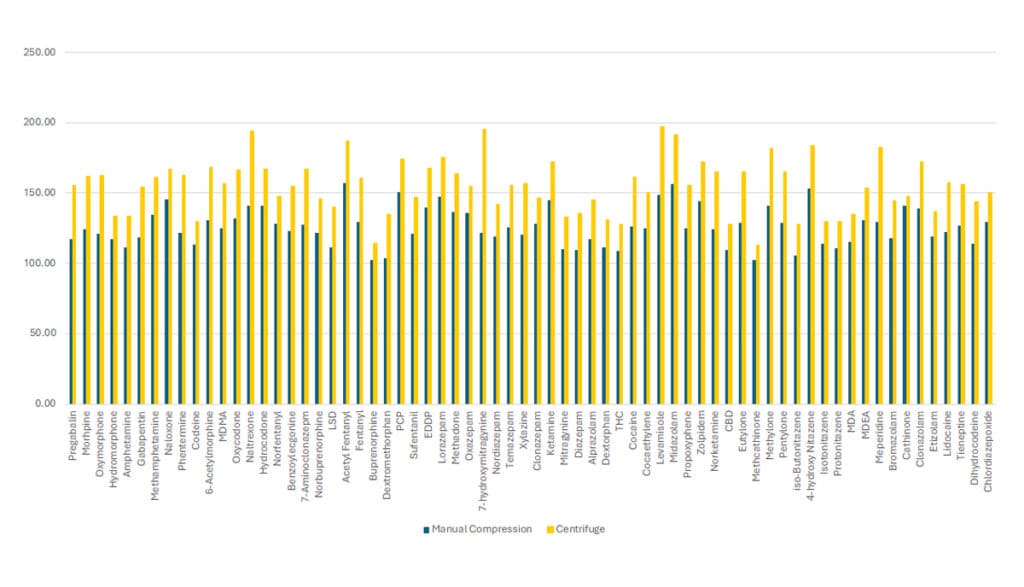
口腔液採取キットを使用する場合、マトリックスと緩衝液を採取装置内のスポンジから除去することが非常に重要です。スポンジからサンプルを回収する主な方法は、手動圧搾と遠心分離の2つです。Figure 4から分かるように、遠心分離では4 mL全量がほぼ回収されたのに対し、手動圧搾では約3 mLが回収されたのみでした。

スポンジからすべての口腔液と緩衝液を抽出するには、遠心分離がより効果的であることは明らかです。ただし、緩衝液に浸されたスポンジはもろくなっており、高速で遠心分離するとアプリケーターから簡単に外れてしまうので、遠心分離時にはスポンジの取り扱いに注意が必要です。遠心分離前にスポンジをチューブの側面に折りたたむことを推奨しています。
サンプル回収量がどの程度分析成分の回収率に影響を与えるかを確認するために、中程度のQC濃度(150 ng/mL)のサンプルを手動圧搾と遠心分離で回収しました。このメソッドに含まれる68種類の分析成分の回収率はすべて、遠心分離を使用した場合の方が良好でした(Figure 5参照)。
クロマトグラフィー性能
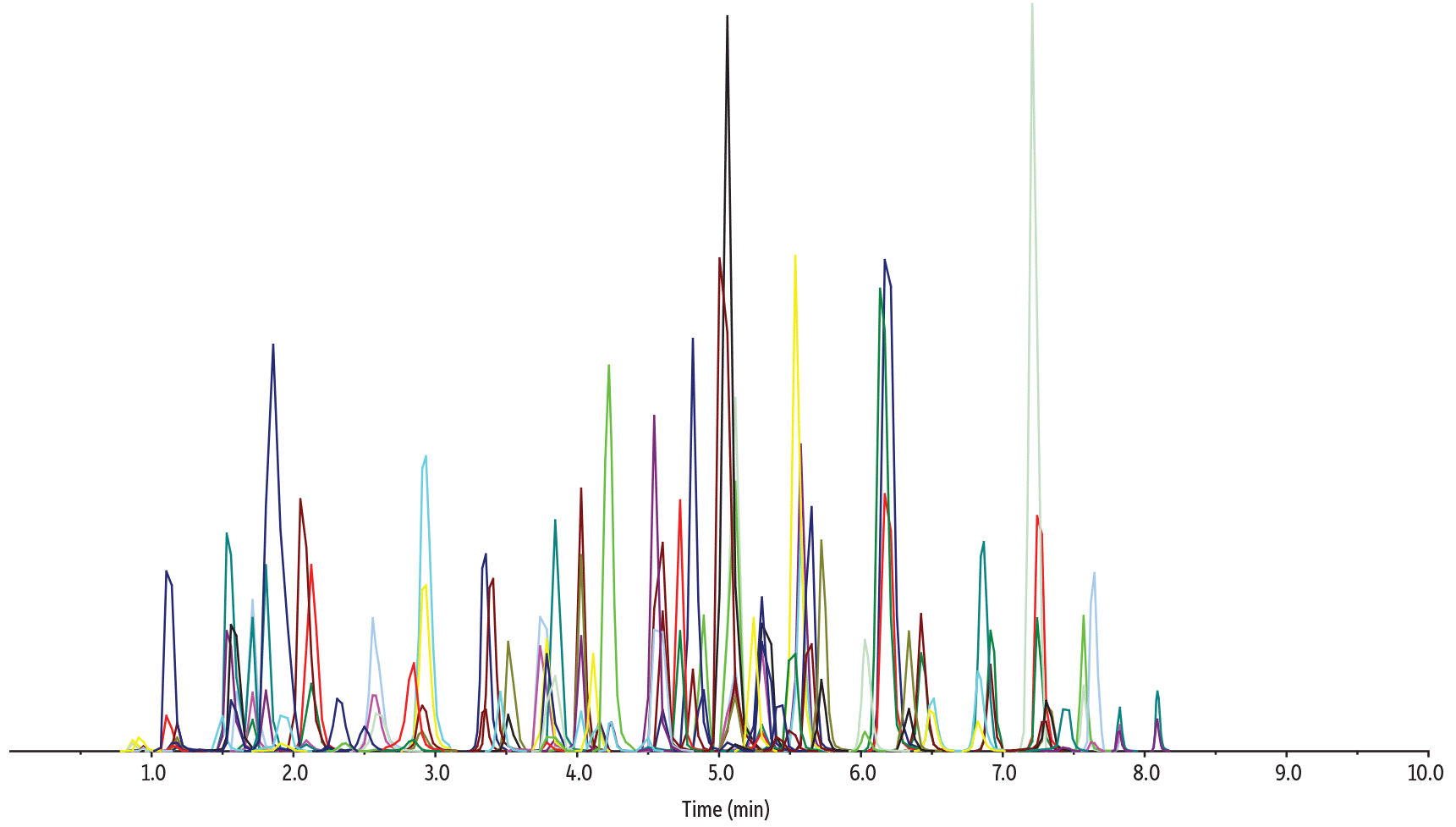
Figure 6に示すように、SALLEによるサンプル前処理を採用した本分析条件では、口腔液サンプル中の新規精神活性物質を含む全68種類の乱用薬物を、10分のサイクルタイムで測定することが可能でした。分析には、LC-MS/MS用Raptor Biphenylカラム(50 × 2.1 mm、2.7 µm)を使用しました。また、このメソッドでは、すべての同重体のクロマトグラフィー分離が適切に行われたため、正確な定量が可能でした。
直線性
線形回帰(1/x 重み付け)を用いると、すべての分析成分は、いずれのサンプル前処理法においても0.991以上の許容可能なR²値を示しました。ターゲットの乱用薬物の分析範囲をTable IIIに示します。
Table III: 口腔液に含まれる分析成分の分析範囲
| 分析成分 | 線形範囲 (ng/mL) | 分析成分 | 線形範囲 (ng/mL) |
|---|---|---|---|
| Morphine | 2-1000 | Cocaine | 2-1000 |
| Pregabalin | 50-10,000 | 7-hydroxymitragynine | 10-1000 |
| Oxymorphone | 2-1000 | LSD | 2-1000 |
| Cathinone | 2-1000 | Cocaethylene | 2-1000 |
| Amphetamine | 2-1000 | Norbuprenorphine | 2-1000 |
| Hydromorphone | 2-1000 | Chlordiazepoxide | 2-1000 |
| Gabapentin | 50-10,000 | Acetyl Fentanyl | 2-1000 |
| Methcathinone | 5-1000 | Zolpidem | 2-1000 |
| MDA | 2-1000 | Fentanyl | 2-1000 |
| Methamphetamine | 2-1000 | Dextromethorphan | 2-1000 |
| Phentermine | 2-1000 | Isotonitazene | 2-1000 |
| Methylone | 2-1000 | Buprenorphine | 2-1000 |
| Lidocaine | 2-1000 | PCP | 2-1000 |
| Naloxone | 2-1000 | Midazolam | 2-1000 |
| Dihydrocodeine | 5-1000 | Propoxyphene | 2-1000 |
| MDMA | 2-1000 | Tianeptine | 2-1000 |
| Codeine | 2-1000 | Protonitazene | 2-1000 |
| 6-Acetylmorphine | 2-1000 | Sufentanil | 2-1000 |
| Levamisole | 2-1000 | EDDP | 2-1000 |
| Oxycodone | 2-1000 | Mitragynine | 2-1000 |
| Naltrexone | 2-1000 | Iso-Butonitazene | 5-1000 |
| MDEA | 2-1000 | Methadone | 2-1000 |
| Hydrocodone | 2-1000 | Lorazepam | 2-1000 |
| Norketamine | 2-1000 | Oxazepam | 2-1000 |
| Eutylone | 2-1000 | Clonazepam | 2-1000 |
| Norfentanyl | 2-1000 | Nordiazepam | 5-1000 |
| 4-Hydroxy nitazene | 2-1000 | Clonazolam | 2-1000 |
| Pentylone | 2-1000 | Alprazolam | 2-1000 |
| Dextrorphan | 5-1000 | Temazepam | 2-1000 |
| Xylazine | 5-1000 | Bromazolam | 2-1000 |
| Ketamine | 5-1000 | Etizolam | 2-1000 |
| Benzoylecgonine | 2-1000 | Diazepam | 2-1000 |
| Meperidine | 2-1000 | Delta-9-THC | 5-1000 |
| 7-Aminoclonazepam | 5-1000 | Cannabidiol | 5-1000 |
精度と再現性
精度と再現性は、SLEおよびSALLEサンプル前処理法を使用して複数日にわたって確認されました。定量限界(LOQ)、定量限界(低)、定量限界(中)、および定量限界(高)での回収率が期待値の±15%以内に収まることで、両方の前処理法においてメソッドの精度が実証されました。同日内および別日間の再現性も、%RSDがSLEで9.12%以下、SALLEで7.45%以下と、許容範囲内でした。
カラム堅牢性
カラムの堅牢性は、SLEおよびSALLEを使用した前処理済みサンプルを250回以上連続してマトリックス注入してテストしました。Raptor Biphenylカラムは非常に安定した結果を示し、68種類の乱用薬物すべてにおいて、最初と最後の注入の保持時間の変動は6.21%以内でした。
結論
今回の実験で実証したSALLEおよびSLEを採用したサンプル前処理法は、従来のSPEに比べて大幅な時間短縮と作業効率化を実現しました。また、LC-MS/MSによる高感度・高精度な口腔液中の薬物分析(68種類の乱用薬物および新規精神活性物質の分析)を可能にしました。SALLEは多様な薬物に、SLEは特定の薬物グループに適しており、目的に応じて使い分けが可能です。どちらのサンプル前処理法でも、希釈注入法に比べて分析成分の回収率が向上し、緩衝液除去も効果的に行われたため、カラム寿命が長くなり、下流におけるメソッドへの影響が低減できました。SALLEとSLEは、いずれもシンプルな手順、短時間で実行できるため、従来の、時間がかかり複雑な手順のSPEと比べてメリットがあります。今後、口腔液中の乱用薬物の分析に使用されることが増えていくでしょう。
参考文献
- E.J. Cone, M.A. Huestis, Marilyn, Interpretation of oral fluid tests for drugs of abuse, Ann NY Acad Sci, 1098 (2007) 51-103. https://doi.org/10.1196/annals.1384.037
- S. Uljon, Chapter One-Advances in fentanyl testing, Advances in Clinical Chemistry, 116 (2023)1-30. https://doi.org/10.1016/bs.acc.2023.05.004
このメソッドは研究用途のみに開発されており、診断に使用するにはさらなる検証が必要です。