LC-MS/MSを用いた異性体分離
近年、Δ8-THCはΔ9-THCの「合法的」な代替品として注目を集めています。その流通拡大に伴い、毒物検査ラボにおいてΔ8-THCとΔ9-THCの異性体を正確に識別する必要性も高まってきています。特にLC-MS/MSを用いるラボでは、これらの異性体およびその代謝物を完全に分離し、正確に定量することが求められます。従来、カンナビノイド分析にはBiphenylやC18などのHPLC固定相が多用されてきましたが、これらのカラムではΔ8-THCとΔ9-THCの異性体分離に十分な選択性が得られず、ピークの重なりや定量誤差のリスクが残っていました。こうした課題に対し、Raptor FluoroPhenylカラムが新たな選択肢として登場しました。このカラムは独自の選択性を持ち、Δ8-THC、Δ9-THC、およびその代謝物(カルボキシ体やヒドロキシ体)を、尿や全血といった複雑なマトリックス中でも完全に分離できます。アプリケーションノート「全血・尿中THC異性体および代謝物の高感度LC-MS/MSメソッド」では、このRaptor FluoroPhenylカラムを用いた全血および尿中のTHC異性体・代謝物の完全分離と定量を可能にするLC-MS/MSワークフローを詳細に紹介していますのでぜひこちらもご参照ください。
半合成カンビナノイドの出現
さて、最近問題なのは、市場に登場してきた多くの新規カンナビノイド、つまり「半合成カンナビノイド」です。なぜ「半合成」なのでしょうか。それは、大麻やヘンプに本来ごく微量しか含まれない成分を合成し「天然由来」としたり、既存の化学構造をわずかに改変して全く新しい物質を作り出したりしているからです。そこで、2025年の初め、法科学研究教育センター(CFSRE)は、四半期ごとに発表するスコープ勧告(英語のみ)に「半合成カンナビノイド」のカテゴリーを新たに追加しました。こうした化合物の存在感が高まってきているため、毒物検査ラボはこれらの新しいカンナビノイドを既存のΔ8/Δ9-THC分析メソッドで検出、定量する必要性を感じていることでしょう。
しかし、既存メソッドに新しい化合物を追加することは、特に異性体が含まれる場合、決して簡単ではありません。新たな化合物を正確に検出・定量するためには、メソッド全体の条件を見直す必要があります。その上、他の分析対象成分が従来通り適切に分離・検出できることも確認しなければなりません。場合によっては、新しい分析対象成分が追加されたことにより、ランタイムが長くなることの許容やワークフローの変更が必要になることもあります。
以下に記載したように、Δ8-THC、Δ9-THC、およびそれらのヒドロキシ代謝物とカルボキシ代謝物の分析用に開発された既存メソッドに、新たな化合物として6種類の半合成カンナビノイドを追加しました。このメソッドは、アプリケーションノート「全血・尿中THC異性体および代謝物の高感度LC-MS/MSメソッド」に、全血分析メソッドとして記載されています。今回追加した6種類の半合成カンナビノイド(9(R)-HHC、9(S)-HHC、Δ10-THC、THC-O-Acetate、THCP、CBDP)は、CFSREによって現在の推奨範囲として特定されています。9(R)-HHCと9(S)-HHCはエピマーの関係にあり、THCPとCBDPはそれぞれ異性体です。また、Δ10-THCはΔ8-THCとΔ9-THCの別の異性体です。
メソッド条件とクロマトグラムの比較
分析対象成分100 ng/mLを含むサンプルの分析を、オリジナルのメソッド条件で実行しました。メソッド条件とクロマトグラムを以下に示します。
Figure 1. オリジナルのメソッド条件と新しい半合成カンナビノイドを含むクロマトグラム
| カラム | Raptor FluoroPhenyl 100 x 3 mm, 2.7 µm (cat.# 9319A1E) | ||
| 移動相A | 水,、0.1% ギ酸 | ||
| 移動相B | メタノール、0.1% ギ酸 | ||
| カラム温度 | 40°C | ||
| 流速 | 0.8 mL/min | ||
| グラジエント | 時間 (min) | %A | %B |
| 0.00 | 36 | 64 | |
| 6.50 | 36 | 64 | |
| 6.60 | 32 | 68 | |
| 13.00 | 32 | 68 | |
| 13.10 | 0 | 100 | |
| 14.00 | 0 | 100 | |
| 14.10 | 36 | 64 | |
| 16.00 | 36 | 64 | |
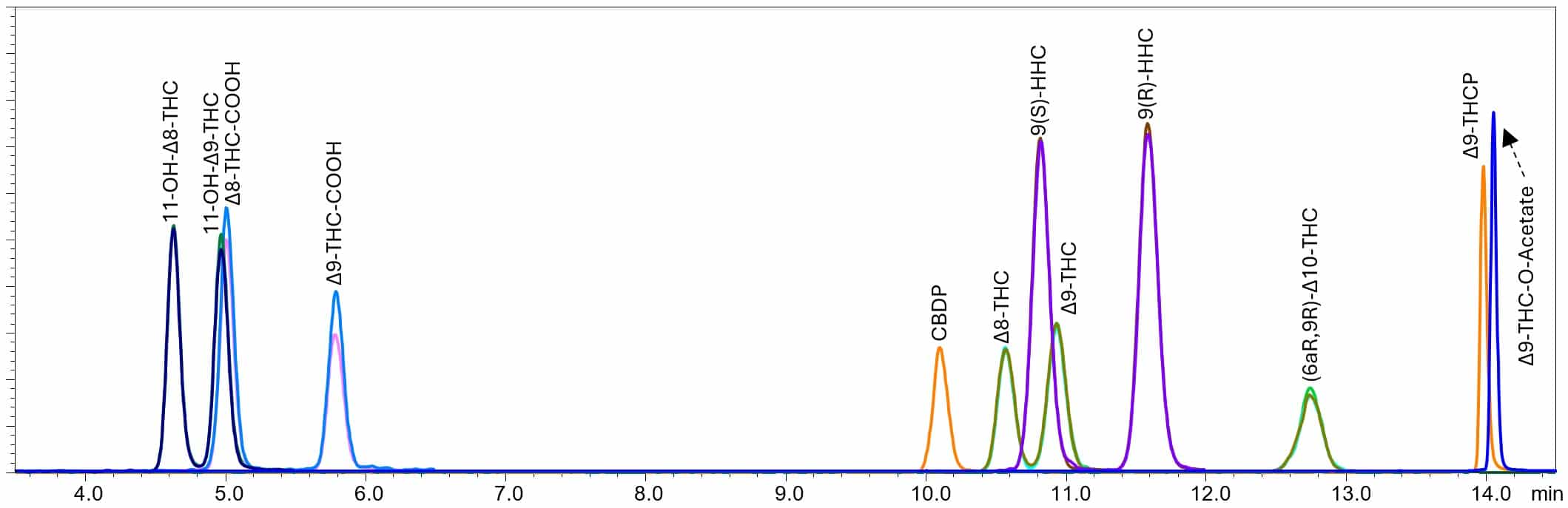
オリジナルのメソッド条件で分析を行ったところ、すべてのクリティカルペアは良好に分離されました。しかし、THCPとTHC-O-Acetateは疎水性が非常に高いため保持時間が長く、移動相Bを100%までグラジエントした後、約14分になってようやく溶出しました。一般的に、マトリックス由来の疎水性成分や非常に親油性の高い化合物をカラムから完全に溶出させる、または洗い出すために、有機溶媒濃度を100%にした状態で一定時間保持することがあります。このステップは、次のサンプル分析時のキャリーオーバーを低減する効果もあります。一方で、マトリックス由来の疎水性成分はこの領域で共溶出しやすく、分析対象成分のピークに干渉を及ぼす可能性があります。したがって、分析対象成分がこの領域で溶出するのは望ましいことではありません。そこで、クリティカルペアの分離を維持しつつ、これらの分析対象成分の検出性能を向上させるよう、メソッドパラメータを最適化しました。調整後のメソッド条件とその条件下で得られたクロマトグラムを以下に示します。
Figure 2. 調整後のメソッド条件およびクロマトグラム
| カラム | Raptor FluoroPhenyl 100 x 3 mm, 2.7 µm (cat.# 9319A1E) | ||
| 移動相A | 水,、0.1% ギ酸 | ||
| 移動相B | メタノール、0.1% ギ酸 | ||
| カラム温度 | 30°C | ||
| 流速 | 0.8 mL/min | ||
| グラジエント | 時間 (min) | %A | %B |
| 0.00 | 34 | 66 | |
| 5.50 | 34 | 66 | |
| 5.60 | 30 | 70 | |
| 10.50 | 30 | 70 | |
| 11.00 | 15 | 85 | |
| 13.00 | 0 | 100 | |
| 14.00 | 0 | 100 | |
| 14.10 | 34 | 66 | |
| 16.00 | 34 | 66 | |
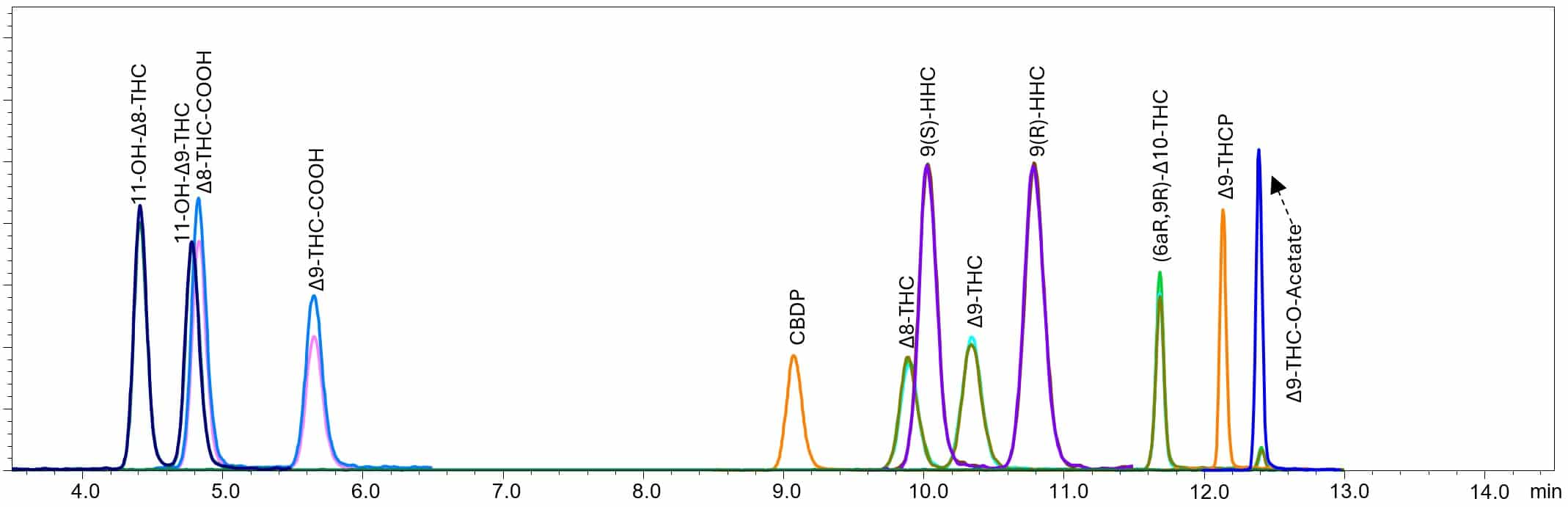
結論
調整後のメソッド条件で分析を行った結果、移動相Bを100%に保持する時間(13~14分)前に、オリジナルのメソッド条件での分析よりも早い保持時間でTHCPおよびTHC-O-Acetateは溶出しました。これは、カラム温度を40℃から30℃に下げてクリティカルペア間の分離を向上させ、さらに溶出グラジエントを最適化したことによります。このように、6種類の半合成カンナビノイドを、ランタイムはそのままに、Δ8/9-THCおよびその代謝物の分析メソッドに無理なく組み込むことが出来ました。



