Zusammenfassung
Für die gleichzeitige Analyse ultrakurzkettiger, alternativer und traditioneller per- und polyfluorierter Alkylverbindungen (PFAS) in unterschiedlichen Wasserproben wurde eine einfache LC-MS/MS-Methode mit direkter Injektion entwickelt und ausgewertet. Diese Methode wird empfohlen, wenn ein einziges Verfahren zur Analyse von Verbindungen aus allen drei PFAS-Kategorien in Trink- und Brauchwasser gewünscht wird.
Einführung
LC-MS/MS-Methoden für die Analyse traditioneller kurzkettiger (C4, C5) und langkettiger (>C5) per- und polyfluorierter Alkylverbindungen (PFAS) auf Basis der Reversed-Phase (RP)-Chromatografie sind allgemein bekannt. Entsprechend modifiziert können diese Methoden häufig auch für die LC-MS/MS-Analyse alternativer PFAS wie HFPO-DA (GenX) und ADONA verwendet werden. Hierbei handelt es sich um perfluorierte Alkylethercarbonsäuren, die als Ersatzstoffe für PFOA eingesetzt werden. Das in China produzierte F-53B ist ebenso ein PFOS-Ersatzstoff mit zwei polyfluorierten Alkylethersulfonat-Komponenten, 9Cl-PF3ONS und 11Cl-PF3OUdS, die als Analyte in der aktualisierten EPA-Methode 537.1 enthalten sind. Aktuelle LC-Methoden sind jedoch für die Analyse der neuen ultrakurzkettigen (C2, C3) PFAS vor allem aufgrund deren mangelnder Retention auf typischen RP-Säulen möglicherweise nicht geeignet.
Obwohl kurzkettige PFAS (PFBA und PFBS) für spezifische Zwecke eingesetzt werden, haben zahlreiche Untersuchungen das allgegenwärtige Vorkommen von C2- und C3-PFAS in Umweltwasserproben belegt [1,2]. Dazu gehören Trifluoressigsäure (TFA), Perfluorpropansäure (PFPrA), Perfluorethansulfonat (PFEtS) und Perfluorpropansulfonat (PFPrS). In Regen- und Schneeproben aus den USA, Frankreich und Japan wurde PFPrA als überwiegende PFAS (bis zu 45 % der insgesamt nachweisbaren PFAS) identifiziert [3]. Bislang sind die Quellen und das Ausmaß der Kontamination durch diese ultrakurzkettigen PFAS nicht eindeutig geklärt. Eine aktuelle Studie konnte jedoch PFEtS und PFPrS in wasserfilmbildenden Schaummitteln (AFFFs) und im Grundwasser von 11 Militärstützpunkten in den USA (oft für Feuerlöschübungen verwendet) nachweisen [4]. Das lässt vermuten, dass AFFF-Feuerlöschschaum eine Quelle für ultrakurzkettige PFAS sein könnte.
Methoden, mit denen ultrakurzkettige, alternative und traditionelle PFAS gleichzeitig analysiert werden können, sind derzeit äußerst selten. Zur Schließung dieser Lücke haben wir ein Verfahren zur simultanen quantitativen Bestimmung einer Reihe von Verbindungen mit unterschiedlichen Kettenlängen und Strukturen einschließlich C3, C4 und C8 sowie alternativer PFAS in einer Vielzahl von Wasserproben entwickelt.
Experimenteller Teil
Probenvorbereitung
In einem Polypropylenfläschchen wurden 250 µL Aliquote der Wasserprobe mit 250 µL Reagenzwasser:Methanol (40:60) und 5 µL interner Standardlösung (5 ng/mL of 13C2-PFHxA, 13C2-PFOA, 13C4-PFOS in Methanol) vermischt. Das Fläschchen wurde mit einem Polyethylendeckel verschlossen und der Inhalt wurde zur Analyse injiziert.
Kalibrierstandards und Qualitätskontrollproben
Kalibrierstandards wurden hergestellt, indem Reagenzwasser (Optima LC-MS Wasser) mit zehn PFAS-Analyten in einem Konzentrationsbereich von 5–400 ng/L angereichert wurde. Diese Standardlösungen wurden dann wie im Abschnitt Probenvorbereitung beschrieben verarbeitet.
Angereicherte Wasserproben
Leitungswasserproben aus der Restek-Anlage und drei unterschiedliche, von der US-Umweltbehörde EPA zur Verfügung gestellte Wassertypen (Wasser aus dem Chicago River, Grundwasser und Abwasser aus einer öffentlichen Kläranlage) wurden in dieser Studie verwendet. Jeder Wassertyp wurde mit 10 (bzw. 20 ppt für PFPrA) und 80 ppt in zweifacher Ausführung pro Charge angereichert, wobei insgesamt drei Chargen hergestellt und an unterschiedlichen Tagen analysiert wurden. Nichtangereicherte und angereicherte Wasserproben wurden dann wie im Abschnitt Probenvorbereitung beschrieben zur chromatografischen Analyse und quantitativen Bestimmung verarbeitet.
Gerät
Die LC-MS/MS-Analyse der ultrakurzkettigen PFAS simultan mit alternativen und traditionellen PFAS wurde mit einer analytischen Raptor C18 Säule und einem Shimadzu Nexera X2 HPLC, gekoppelt an ein SCIEX 4500 MS/MS, durchgeführt. Zwischen dem Pumpenmixer und dem Injektor wurde eine PFAS-Delay-Säule (Art.-Nr. 27854) installiert, um die Koelution von gerätebedingten PFAS mit Zielanalyten in der Probe zu vermeiden. Das Gerät wurde wie folgt verwendet und die Analytübergänge sind in Tabelle I angegeben.
| Analytische Säule: | Raptor C18 2.7 µm, 100 mm x 3.0 mm (Art.-Nr. 9304A1E) | |
| Delay-Säule: | PFAS Delay-Säule (Art.-Nr. 27854) | |
| Mobile Phase A: | 5 mM Ammoniumacetat in Wasser | |
| Mobile Phase B: | Methanol | |
| Gradient | Zeit (min) | %B |
| 0.00 | 20 | |
| 7.00 | 95 | |
| 9.00 | 95 | |
| 9.01 | 20 | |
| 11.0 | 20 | |
| Flussrate: | 0.25 mL/min | |
| Laufzeit: | 11 min | |
| Injektionsvolumen: | 10 µL | |
| Säulentemperatur.: | 40 °C | |
| Ionisationsmodus: | ESI- | |
| Ionenspray-Spannung: | -2000 | |
| Ionenquellentemperatur: | 450 °C | |
Tabelle I: Ionenübergänge bei der LC-MS/MS-Analyse ultrakurzkettiger PFAS gleichzeitig mit alternativen und traditionellen PFAS.
| Peak ID | Verbindung | Precursor-Ion | Produkt-Ion | Interner Standard |
|---|---|---|---|---|
| 1 | PFPrA | 162.9 | 119.0 | 13C2-PFHxA |
| 2 | PFBA | 212.8 | 169.0 | 13C2-PFOA |
| 3 | PFPrS | 248.8 | 79.6 | 13C2-PFHxA |
| 4 | PFBS | 298.8 | 79.9 | 13C2-PFHxA |
| 5 | 13C2-PFHxA | 314.9 | 270.0 | — |
| 6 | HFPO-DA | 285.0 | 168.9 | 13C2-PFOA |
| 7 | ADONA | 376.9 | 250.7 | 13C2-PFOA |
| 8 | PFOA | 413.1 | 368.9 | 13C2-PFOA |
| 9 | 13C2-PFOA | 415.0 | 370.0 | — |
| 10 | PFOS | 498.8 | 80.0 | 13C4-PFOS |
| 11 | 13C4-PFOS | 503.0 | 80.0 | — |
| 12 | 9Cl-PF3ONS | 530.8 | 350.7 | 13C4-PFOS |
| 13 | 11Cl-PF3OUdS | 630.7 | 451.0 | 13C4-PFOS |
Ergebnisse und Diskussion
Chromatografische Performance
Die Peakformen, Retention und Intensität der Analyte waren bei den Reagenzwasser- und den Gewässer-/Abwasserproben ähnlich. Bei den Gewässer-/Abwasserproben wurde eine höhere Baseline für das PFPrA-Signal beobachtet (Abbildung 1). Dies hatte jedoch keinen nachteiligen Einfluss auf die Peakintegration und die quantitative Bestimmung des PFPrA. Bei durch zweifache Verdünnung hergestellten Wasserproben wurden keine Matrixeffekte beobachtet.
80 ppt Reagenzwasserstandard
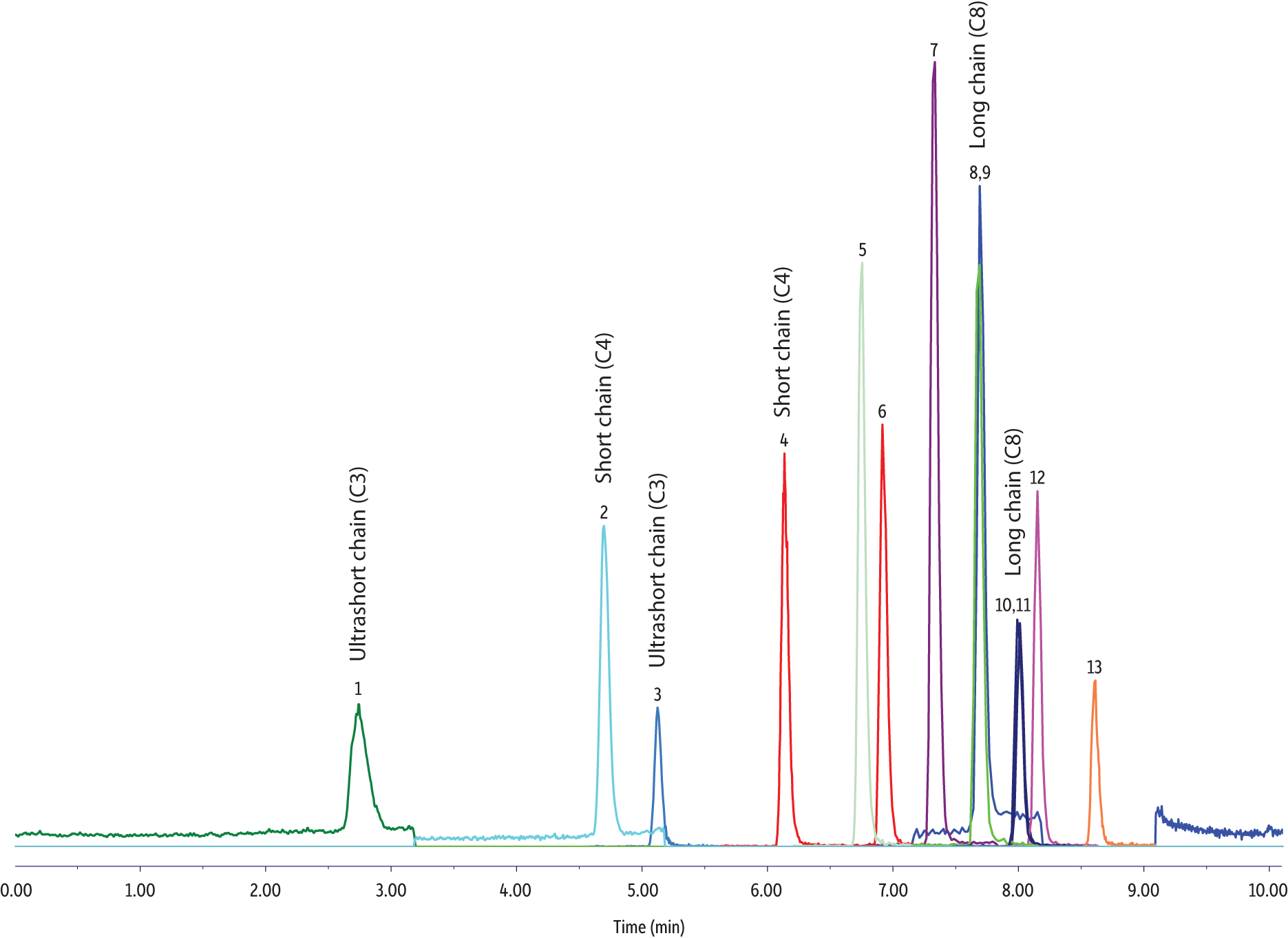
LC_EV0555
Peaks
| Peaks | tR (min) | Conc. (ng/L) | Precursor Ion | Product Ion | |
|---|---|---|---|---|---|
| 1. | Perfluoropropanoic acid (PFPrA) | 2.74 | 80 | 162.9 | 119.0 |
| 2. | Perfluorobutanoic acid (PFBA) | 4.69 | 80 | 212.8 | 169.0 |
| 3. | Perfluoropropanesulfonic acid (PFPrS) | 5.13 | 80 | 248.8 | 79.6 |
| 4. | Perfluorobutanesulfonic acid (PFBS) | 6.14 | 80 | 298.8 | 79.9 |
| 5. | Perfluoro-n-[1,2-13C2]hexanoic acid (13C2-PFHxA) | 6.75 | 50 | 314.9 | 270.0 |
| 6. | Hexafluoropropylene oxide-dimer acid (HFPO-DA) | 6.92 | 80 | 285.0 | 168.9 |
| Peaks | tR (min) | Conc. (ng/L) | Precursor Ion | Product Ion | |
|---|---|---|---|---|---|
| 7. | Ammonium 4,8-dioxa-3H-perfluorononanoate (ADONA) | 7.33 | 80 | 376.9 | 250.7 |
| 8. | Perfluorooctanoic acid (PFOA) | 7.70 | 80 | 413.1 | 368.9 |
| 9. | Perfluoro-[1,2-13C2]octanoic acid (13C2-PFOA) | 7.70 | 50 | 415.0 | 370.0 |
| 10. | Perfluorooctanesulfonic acid (PFOS) | 8.01 | 80 | 498.8 | 80.0 |
| 11. | Perfluoro-[1,2,3,4-13C4]octanesulfonic acid (13C4-PFOS) | 8.01 | 50 | 503.0 | 80.0 |
| 12. | 9-Chlorohexadecafluoro-3-oxanonane-1-sulfonate (9Cl-PF3ONS) | 8.15 | 80 | 530.8 | 350.7 |
| 13. | 11-Chloroeicosafluoro-3-oxanonane-1-sulfonate (11Cl-PF3OUdS) | 8.61 | 80 | 630.7 | 451.0 |
80 ppt Angereicherte Grundwasserprobe
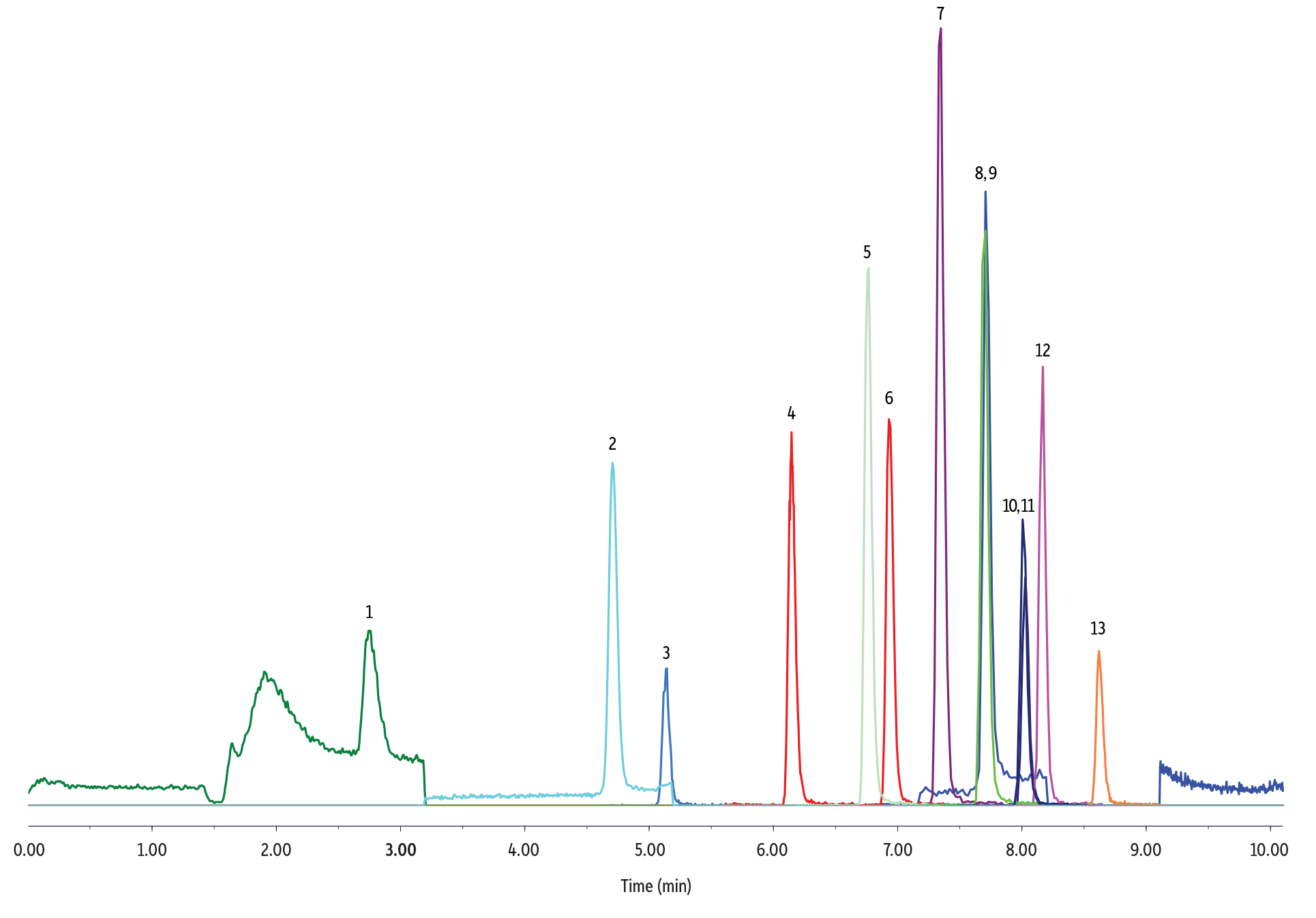
LC_EV0556
Conditions
| Column | Raptor C18 (cat.# 9304A1E) | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dimensions: | 100 mm x 3 mm ID | ||||||||||||||||||||||||
| Particle Size: | 2.7 µm | ||||||||||||||||||||||||
| Pore Size: | 90 Å | ||||||||||||||||||||||||
| Temp.: | 40 °C | ||||||||||||||||||||||||
| Standard/Sample | |||||||||||||||||||||||||
| Conc.: | 80 ppt | ||||||||||||||||||||||||
| Inj. Vol.: | 10 µL | ||||||||||||||||||||||||
| Mobile Phase | |||||||||||||||||||||||||
| A: | Water, 5 mM ammonium acetate | ||||||||||||||||||||||||
| B: | Methanol | ||||||||||||||||||||||||
|
| Detector | MS/MS |
|---|---|
| Ion Mode: | ESI- |
| Mode: | MRM |
| Instrument | UHPLC |
| Sample Preparation | In a polypropylene vial, 250 µL of groundwater sample (fortified at 80 ppt) was mixed with 250 µL of 40:60 reagent water:methanol and 5 µL of internal standard solution (5 ng/mL of 13C2-PFHxA, 13C2-PFOA, 13C4-PFOS in methanol). The vial was capped with a polyethylene cap prior to analysis. |
| Notes | A PFAS delay column (cat.# 27854) was installed between the pump mixer and the injector. |
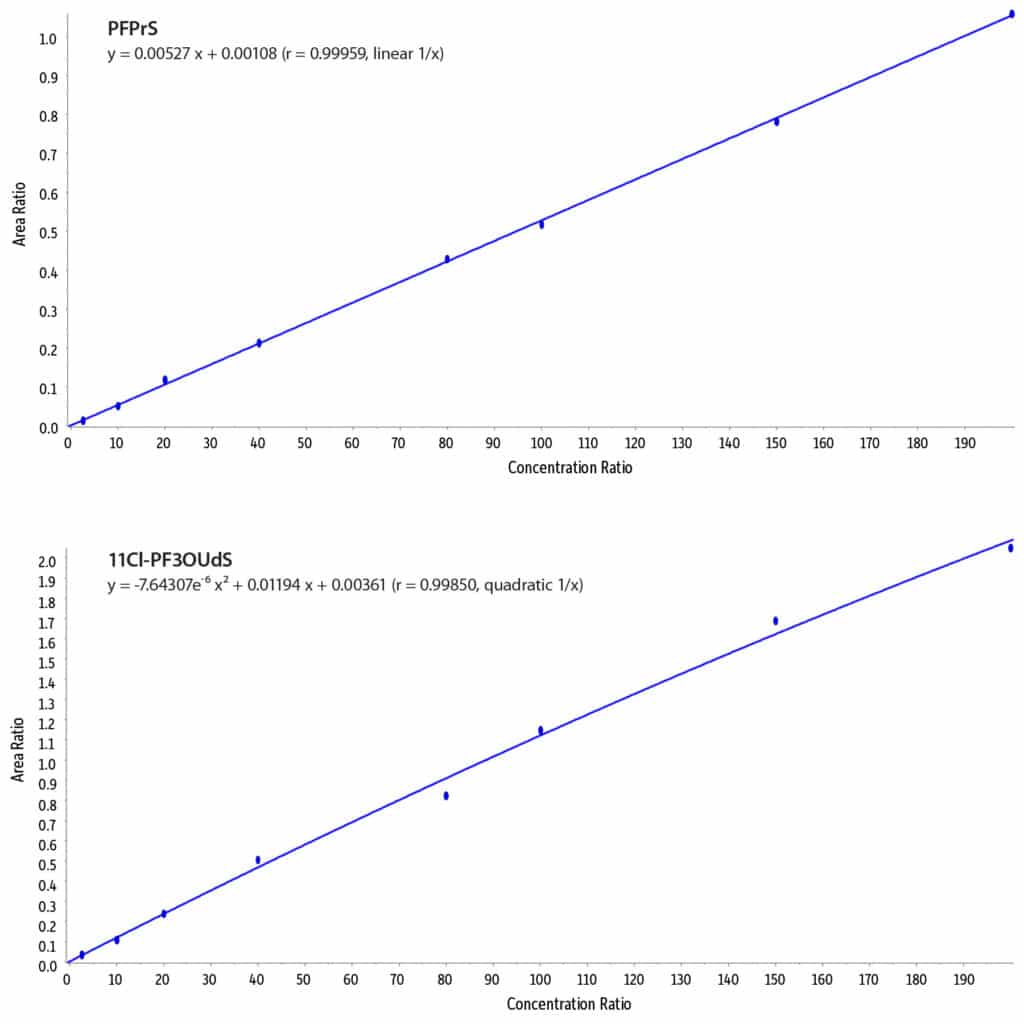
Linearität
Bei dieser LC-MS/MS-Methode zur gleichzeitigen Analyse ultrakurzkettiger PFAS mit alternativen und traditionellen PFAS betrug der Kalibrierbereich 10-400 ppt für PFPrA und 5-400 ppt für alle anderen Analyte. Alle Verbindungen zeigten akzeptable Linearität mit r-Werten ≥0,999 und Abweichungen von weniger als 20 %. 11Cl-PF3OUdS wurde als einziger Analyt mithilfe einer durch quadratische Regression erhaltenen Standardkurve (gewichtet 1/x) quantifiziert. Alle anderen Analyte wurde mithilfe einer linearen Regressionskurve (gewichtet 1/x) quantitativ bestimmt (Abbildung 2).
Richtigkeit und Genauigkeit
Die nicht angereicherten Wasserproben zeigten unterschiedliche Konzentrationen von C3, C4 und C8 PFAS ohne nachweisbares PFPrS, ADONA, HFPO-DA, 9Cl-PF3ONS und 11Cl-PF3OUdS (Tabelle II). Zur Berechnung der Richtigkeit (% Wiederfindung) wurde die gemessene Menge des Analyten in der angereicherten Probe unter Zuhilfenahme der Konzentration der nichtangereicherten Probe korrigiert. Tabelle III zeigt die Ergebnisse für Richtigkeit und Genauigkeit für die Datensätze aller drei Chargen. Die Richtigkeit der Methode wurde durch Wiederfindungswerte innerhalb von 20 % der nominellen Konzentration bei beiden Konzentrationen der angereicherten Proben und durch den in Reagenzwasser hergestellten LLOQ-Konzentrationsstandard belegt. Die relative Standardabweichung %RSD war kleiner als 15 %, was auf eine akzeptable Genauigkeit der Methode hindeutet.
Tabelle II: PFAS-Konzentrationen in nichtangereicherten Wasserproben.
| Nachgewiesene Konzentration (ng/L) | ||||||||||
| PFPrA | PFBA | PFPrS | PFBS | HFPO-DA | ADONA | PFOA | PFOS | 9Cl-PF3ONS | 11Cl-PF3OUdS | |
| Leitungswasser | ND | 1.1 | ND | ND | ND | ND | ND | ND | ND | ND |
| Flusswasser | ND | 1.6 | ND | ND | ND | ND | ND | ND | ND | ND |
| Grundwasser | 9.0 | 3.4 | ND | 2.6 | ND | ND | ND | ND | ND | ND |
| Abwasser aus öffentlicher Kläranlage | 11.7 | 10.6 | ND | 3.0 | ND | ND | 15.0 | 6.0 | ND | ND |
Tabelle III: Richtigkeit und Genauigkeit.
| Konzentration (ng/L) | Average %Recovery (%RSD) | ||||||||
| Leitungswasser | Flusswasser | Grundwasser | Abwasser aus öffentlicher Kläranlage | Reagenzwasser | |||||
| 10* | 80 | 10* | 80 | 10* | 80 | 10* | 80 | 5** (LLOQ) | |
| PFPrA | 96.9 (11.0) | 105 (3.91) | 105 (6.57) | 95.4 (6.84) | 92.0 (9.54) | 99.4 (7.40) | 94.2 (5.29) | 87.2 (8.18) | 103 (10.9) |
| PFBA | 99.3 (9.19) | 108 (1.81) | 108 (5.20) | 110 (1.70) | 104 (8.21) | 108 (6.68) | 108 (8.12) | 97.1 (8.17) | 97.9 (12.0) |
| PFPrS | 100 (4.24) | 107 (3.14) | 103 (6.71) | 105 (2.64) | 105 (8.48) | 109 (6.68) | 109 (5.65) | 103 (9.28) | 99.1 (8.59) |
| PFBS | 101 (5.20) | 106 (1.84) | 99.7 (7.54) | 105 (2.10) | 100 (6.57) | 106 (2.82) | 103 (1.93) | 97.8 (5.85) | 96.0 (8.75) |
| HFPO-DA | 96.2 (7.86) | 102 (4.64) | 96.2 (4.99) | 105 (3.94) | 95.0 (3.59) | 101 (8.92) | 92.9 (4.87) | 90.3 (7.77) | 99.3 (8.54) |
| ADONA | 101 (6.23) | 106 (3.82) | 97.6 (6.36) | 106 (2.32) | 98.4 (2.68) | 105 (4.08) | 98.2 (7.09) | 98.2 (7.09) | 102 (10.3) |
| PFOA | 105 (8.65) | 105 (3.70) | 108 (12.1) | 107 (3.63) | 108 (9.66) | 105 (5.26) | 99.9 (10.5) | 94.5 (7.24) | 100 (9.05) |
| PFOS | 99.3 (2.10) | 108 (4.24) | 112 (1.87) | 107 (4.93) | 101 (2.96) | 102 (2.31) | 104 (4.46) | 98.3 (5.82) | 94.3 (8.85) |
| 9Cl-PF3ONS | 95.6 (4.60) | 106 (5.93) | 105 (5.37) | 110 (8.20) | 97.2 (4.52) | 107 (7.41) | 101 (6.52) | 99.8 (4.89) | 98.8 (5.47) |
| 11Cl-PF3OUdS | 114 (8.78) | 112 (8.91) | 102 (15.0) | 91.5 (2.34) | 96.7 (5.99) | 105 (15.2) | 115 (2.67) | 103 (8.45) | 105 (8.04) |
*20 ng/L für PFPrA
**10 ng/L für PFPrA
Schlussfolgerung
Eine robuste LC-MS/MS-Methode mit direkter Injektion zur quantitativen Bestimmung einer Reihe von PFAS unterschiedlicher Kettenlängen und Strukturen wurde an verschiedenen Wasserprobenmatrices ausgewertet. Die analytische Methode mit einer Raptor C18 (2.7 µm) 100 x 3.0 mm-Säule mit zwischengeschalteter PFAS Delay-Säule erwies sich als schnell, robust und empfindlich mit akzeptabler Richtigkeit und Genauigkeit. Diese Methode ist gut geeignet für Labors, die eine erweiterte Liste von PFAS-Verbindungen analysieren müssen, darunter ultrakurzkettige PFAS bei der Prüfung von Trink- und Brauchwasser.
Literatur
- S. Taniyasu, K. Kannan, L.W.Y. Yeung, K.Y. Kwok, P.K.S Lam, N. Yamashita, Analysis of trifluoroacetic acid and other short-chain perfluorinated acids (C2-C4) in precipitation by liquid chromatography-tandem mass spectrometry: comparison to patterns of long-chain perfluorinated acids (C5-C18), Anal. Chim. Acta. 619 (2008) 221-230.
- J. Janda, K. Nodler, H-J. Brauch, C. Zwiener, F.T. Lange, Robust trace analysis of polar (C2-C8) perfluorinated carboxylic acids by liquid chromatography-tandem mass spectrometry: method development and application to surface water, groundwater, and drinking water, Environ. Sci. Pollut.R. 26 (2018) 7326-7336.
- K.Y. Kwok, S. Taniyasu, L.W.Y. Yeung, M.B. Murphy, P.K.S. Lam, Y. Horii, K. Kannan, G. Petrick, R.K. Sinha, N. Yamashita, Flux of perfluorinated chemicals through wet deposition in Japan, the United States, and other countries, Environ. Sci. Technol. 44 (2010) 7043-7049.
- K.A. Barzen-Hanson, J.A. Field, Discovery and implications of C2 and C3 perfluoroalkyl sulfonates in aqueous film-forming foams and groundwater, Environ. Sci. Technol. Lett. 5 (2015) 95-99.





