はじめに
テトラヒドロカンナビノール(Δ9-THC)摂取を調べる全血サンプル検査は、長年にわたり臨床現場で標準的に実施されてきました。Δ9-THCは体内で11-ヒドロキシ-Δ9-THC(11-OH-Δ9-THC)に代謝され、さらに11-ノル-9-カルボキシ-Δ9-THC(Δ9-THC-COOH)へと変換されます。そのため、THCの摂取状況を正確にモニタリングするには、親化合物と2種類の主要代謝物を同時に分析することが不可欠です。
市場に流通するΔ9-THC異性体の増加に伴い、検査も複雑化しているため、異性体を確実に分離する新たなメソッド開発への迅速な対応が求められています。Δ9-THC異性体の中でも、特にΔ8-THCは米国連邦法で規制されていないため、市場における流通量増加が問題となっています。また、Δ8-THCもΔ9-THCと同様にヒドロキシ代謝物(11-OH-Δ8-THC)およびカルボキシ代謝物(Δ8-THC-COOH)に変換されるので、これらの異性体およびその代謝物を明確に分離して検出することが重要になってきます。異性体ペアの分離が不十分な場合、特に一方の異性体が高濃度で存在するケースでは、臨床報告の精度が大きく損なわれるリスクがあり、これを防ぐためにも分析メソッドの更なる進展が強く求められています。
本研究では、全血中に存在する6種類すべての異性体を十分に分離可能な新規LC-MS/MSメソッドを開発し、その直線性、精度、再現性、ならびに他成分からの干渉の有無を総合的に評価しました。
実験
液液抽出 [1]
- ブランクの全血サンプル500 μLをガラス製試験管に加える
- 校正用標準溶液50 μLおよびQC用標準溶液50 μLを各試験管に加えた後、内部標準物質(Δ9-THC-D3、11-OH-Δ9-THC-D3、Δ9-THC-COOH-D3 濃度:1000 ng/mL)50 μLを各サンプルに添加し、ボルテックス
- HPLCグレード水500 μLを各試験管に添加し、ボルテックス
- 1N塩酸100 μLを各試験管に添加し、ボルテックス
- ヘキサン:酢酸エチルを80:20で調製した溶液2.5 mLを各試験管に添加し、キャップをした後、目視で混合が確認できるまでボルテックス
- 4200 rpmで15分間、または2つの層が完全に分離するまで遠心分離
- 各サンプルからの上清を新しい試験管に移し、窒素下で乾固
- 0.1%ギ酸を含む水:メタノールを50:50で調製した溶液100 μLで再溶解しボルテックス、インサート付きのLCバイアルに移したサンプルを分析
装置パラメータ
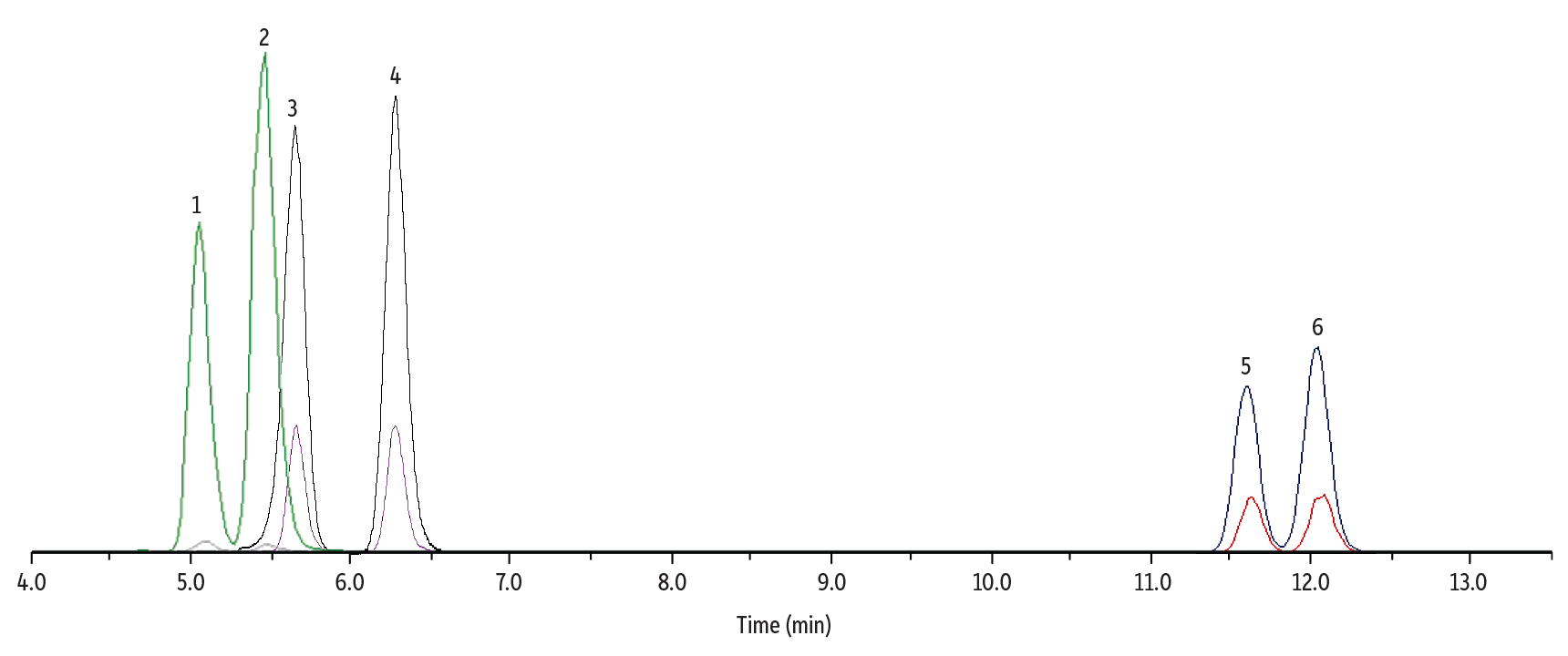
Δ8-THC、Δ9-THC、11-OH-Δ8-THC、11-OH-Δ9-THC、Δ8-THC-COOH、およびΔ9-THC-COOHの分離を最適化するためのLC-MS/MSメソッドをRaptor FluoroPhenylカラムで開発しました(詳細はTable IおよびTable IIを参照)。各分析対象成分のMRMトランジションとESIモードはFigure 1をご参照ください。
Table I: クロマトグラフィーグラジエント
| 時間 (min) | 流速 (mL/min) | %A | %B |
|---|---|---|---|
| 0.00 | 0.8 | 36 | 64 |
| 6.50 | 0.8 | 36 | 64 |
| 6.60 | 0.8 | 32 | 68 |
| 13.00 | 0.8 | 32 | 68 |
| 13.10 | 0.8 | 0 | 100 |
| 14.00 | 0.8 | 0 | 100 |
| 14.10 | 0.8 | 36 | 64 |
| 16.00 | 0.8 | 36 | 64 |
Table II: LCメソッドパラメータ
| 分析用カラム | Raptor FluoroPhenyl, 2.7 μm, 100 mm x 3.0 mm ID (cat.# 9319A1E) |
| ガードカラム | Raptor FluoroPhenyl EXP guard column cartridge 5 mm, 3.0 mm ID, 2.7 μm (cat.# 9319A0253) |
| カラム温度 | 40 °C |
| 移動相A | 0.1% ギ酸水溶液 |
| 移動相B | 0.1% ギ酸メタノール溶液 |
| 注入量 | 10 µL |
結果と考察
クロマトグラフィー性能
Raptor FluoroPhenylカラムを用いた13分間の高速グラジエント(総分析時間16分)により、3組の異性体(計6成分)がすべて良好に分離されました。FluoroPhenyl固定相は、従来のビフェニルやC18カラムと比較して、異性体間の選択性に優れていることが分かります(Figure 1を参照ください)。
直線性・精度・再現性
1/x²重み付け線形回帰を用いて直線性を検証しましたが、すべての分析対象成分が、0.99以上の許容可能なR²値を示し、優れた結果が得られました。11-OH-Δ8-THC、11-OH-Δ9-THC、Δ8-THC、Δ9-THCについては濃度0.5~100 ng/mLに、Δ8-THC-COOHおよびΔ9-THC-COOHについては濃度2.5~500 ng/mLに校正範囲を設定しました。
各サンプルをLow QC(低濃度QC)、Medium QC(中濃度QC)、High QC(高濃度QC)となるようにして、3日間にわたり再現性と精度の評価を実施しました(11-OH-Δ8-THC、11-OH-Δ9-THC、Δ8-THC、Δ9-THCについてはそれぞれの濃度が5、10、50 ng/mLに、Δ8-THC-COOHおよびΔ9-THC-COOHについてはそれぞれの濃度が25、50、250 ng/mLになるような添加サンプルを作成)。すべての濃度において回収率がQCサンプル公称値の±10%以内に収まることが確認され、本メソッドの精度が十分であることが示されました。また、同日内および別日間の%RSDも20%以下を示しており、本メソッドの再現性も許容範囲内であることが確認されました。
分析対象成分間の相互干渉
天然由来のカンナビノイドがターゲット化合物に干渉しないことを実証するために、CBDV、CBD、CBG、THCV、exo-THC、CBL、CBN、Δ10-THC、CBCなど、構造が類似した、または一般的な9種類のカンナビノイドを添加した全血サンプルを用いて検証を行いました。その結果、Raptor FluoroPhenylカラムにより、全てのターゲット化合物がこれら9種類のカンナビノイドから完全に分離され、干渉は認められず、高い選択性が確認されました。(Figure 2を参照ください)。
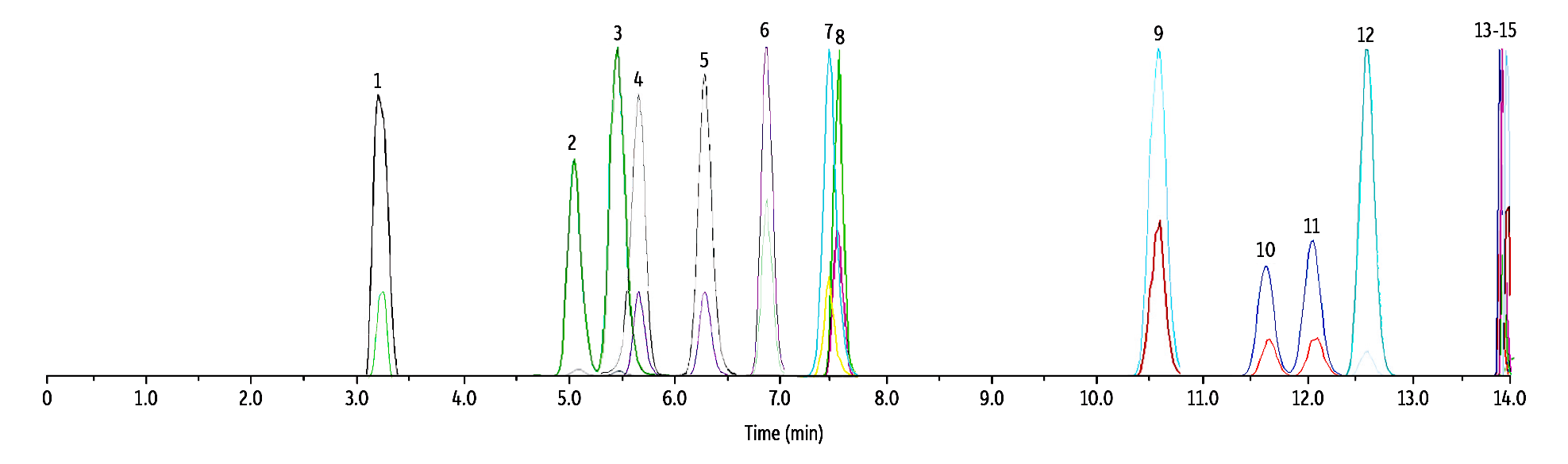
LC_CF0808
Peaks
| Peaks | tR (min) | Conc. (ng/mL) | Precursor | Product 1 | Product 2 | Mode | |
|---|---|---|---|---|---|---|---|
| 1. | CBDV | 3.52 | 50 | 287.4 | 165.0 | 231.1 | + |
| 2. | 11-OH-Δ8-THC | 5.09 | 50 | 331.4 | 313.0 | 193.2 | + |
| 3. | 11-OH-Δ9-THC | 5.50 | 50 | 331.4 | 313.0 | 193.2 | + |
| 4. | Δ8-THC-COOH | 5.53 | 250 | 343.0 | 298.9 | 244.8 | – |
| 5. | Δ9-THC-COOH | 6.44 | 250 | 343.0 | 298.9 | 244.8 | – |
| 6. | CBD | 6.81 | 50 | 315.5 | 193.0 | 259.0 | + |
| 7. | CBG | 7.56 | 50 | 317.5 | 193.0 | 123.0 | + |
| 8. | THCV | 7.65 | 50 | 287.4 | 165.0 | 123.0 | + |
| 9. | exo-THC | 10.63 | 50 | 315.5 | 193.0 | 259.0 | + |
| 10. | Δ8-THC | 11.67 | 50 | 315.5 | 193.0 | 123.0 | + |
| 11. | Δ9-THC | 12.17 | 50 | 315.5 | 193.0 | 123.0 | + |
| 12. | CBL | 12.43 | 50 | 315.5 | 235.2 | 193.0 | + |
| 13. | Δ10-THC | 13.88 | 50 | 315.5 | 193.1 | 259.0 | + |
| 14. | CBN | 13.93 | 50 | 311.4 | 223.0 | 293.1 | + |
| 15. | CBC | 13.93 | 50 | 315.5 | 193.1 | 259.0 | + |
結論
本研究で確立したRaptor FluoroPhenylカラムを用いる高速LC-MS/MSメソッドにより、全血中のΔ8-THCおよびΔ9-THC異性体ならびにそのヒドロキシ/カルボキシ代謝物を効率的かつ高精度に分離分析することが可能であることが示されました。さらに、他のカンナビノイドによる干渉も認められず、本法は臨床検査において信頼性の高い結果報告を可能にする手法であると考えられます。
参照文献
N.B. Tiscione, R . Miller, X . Shan, J . Sprague, D.T. Yeatman, An efficient, robust method for the determination of cannabinoids in whole blood by LC-MS-MS, J. Ana.l Toxicol. 40(8) (2016) 639-648. https://doi.org/10.1093/jat/bkw063