研究亮点:
- 新一代 TriMax 钝化技术:构建了高度稳定且极致中性的样品传输通路,有效降低了柱活性对分析结果的影响。
- 卓越惰性表现:显著改善各种半挥发物的峰形,支持更低校准范围及皮克克级灵敏度,确保微量分析的精确性。
- 色谱柱性能最大化:适用分析物范围广泛,同时可在缩小样品提取体积的前提下保持高效分离与定量能力。


摘要
本研究旨在评估创新 TriMax 钝化技术对 GC-MS/MS 半挥发性化合物分析性能的影响。通过对四种常用分析柱进行系统比较,综合评价指标包括峰形不对称性、校准曲线线性、回收率及重复性,覆盖酸性、碱性及中性半挥发性化合物的广泛化学特性。结果显示,采用 TriMax 钝化技术的RMX-5Sil MS色谱柱表面具有更加显著的惰性,能够在各种化学性质的半挥发性化合物中均表现出优异性能,而其他竞品柱则仅在部分化合物类别中满足标准。该色谱柱在低浓度半挥发性化合物分析中依然保持更优性能,使实验室能够通过缩减样品提取体积或整合分析方法实现操作流程优化。RMX-5Sil MS柱采用的TriMax 去活技术有效克服了竞品柱普遍存在的活性问题,从而保障整体定量分析的可靠性与可重复性。
引言
半挥发性有机化合物(SVOC)因其在环境中的广泛存在及对人类健康的潜在威胁,已成为全球环境监测的重要目标。气相色谱‒质谱联用(GC-MS)及多级质谱(GC-MS/MS)方法是环境样品中半挥发性化合物分析的主要手段。利用 MS/MS 的高灵敏度,实验室不仅可实现更低的检测限,还能通过缩减样品提取体积降低溶剂消耗和实验周期。相较于传统提取方法,低体积提取方法操作简便,且所需溶剂(如二氯甲烷)用量更少,但提取物浓度相对降低。这种特性也正在推动越来越多的实验室采用GC-MS/MS,以在减少溶剂消耗的同时保持方法的分析性能。
半挥发性化合物涵盖了广泛的化学类别,其中部分化合物可能会与样品通路中的活性位点(如硅醇)发生相互作用,从而影响低浓度检测的可靠性。为了克服这些复杂的相互作用,实验室通常会针对不同的目标分析物来选择不同的色谱柱。低极性“5型”或“5sil型”柱是常用选择,但随着对更低检测限的持续追求以及对色谱柱灵敏度的要求不断提高,不同制造工艺带来的性能差异逐渐显现。尽管中性化合物通常不受 GC 柱表面残留活性位点影响,但酸性或碱性化合物对微小表面差异仍高度敏感。在系统适用性验证中,同时包含碱性(如联苯胺)和酸性(如五氯酚)化合物,并伴随对高灵敏度校准的需求,使得 GC 柱表面的活性位点成为分析性能评估的关键因素。因此,具备更广泛的有效钝化的 GC 柱备受重视,因为它们能在酸性、碱性及中性半挥发性化合物上实现更优异的性能,从而帮助实验室通过降低溶剂消耗、提高仪器性能及整合分析方法来提升生产效率和经济效益。
本研究旨在将多种广泛用于半挥发性化合物分析的 GC 柱性能与 RMX-5Sil MS 柱进行系统比较。RMX-5Sil MS 柱采用独特的TriMax 技术对柱表面进行钝化,通过形成稳定的聚合物沉积消除活性位点,从而构建出高度惰性的样品流路。该柱采用传统5sil 聚合物,因此可直接替代现有 5sil 柱;其高度惰性的表面显著改善了酸性、碱性及中性化合物的峰形与定量性能,使更低浓度校准成为可能,同时确保数据质量满足严格标准。
实验部分
标准品与样品制备
酸性、碱性及中性半挥发性化合物校准标准品在二氯甲烷中配制,浓度范围为 0.5‒5000 ppb,以确定各分析物的最低线性校准范围。每种色谱柱均新配校准标准品。此外,制备了 50 ppb 的中点浓度回收率测试标准品,用于评估方法回收率性能。
仪器条件
样品在四种色谱柱上进行分析,包括 RMX-5Sil MS 柱、两种高端竞品柱及一种传统竞品柱,规格均为 30 m × 0.25 mm ID × 0.25 μm。分析采用 Thermo TRACE 1310 GC 联用 TSQ 8000 质谱仪。为实现柱间比较与标准化,实验条件进行了统一设置;实际分析中可根据需要调整进样口、柱箱或检测器条件以进一步优化色谱效果。低浓度优化条件已在一项涵盖 150 种常规分 析半挥发性化合物的研究中展示 [1]。
进样体积:1 μL
衬管:Topaz 4 mm 精准型进样口衬管(含玻璃毛,货号 23267)
进样口条件:250 °C;5:1 分流;载气流量 1.2 mL/min
载气:氦气
柱温程序:40 °C(保持 1 min)升至 280 °C,升温速率 12.4 °C/min,再升至 315 °C,升温速率 3.3 °C/min(保持 1 min)
检测器:MS/MS,SRM 模式;传输线温度 280 °C,离子源温度 330 °C(SRM 转换列表见图 1)
数据质量评估
数据质量通过峰形不对称性、线性、回收率及重复性进行综合评估,各指标表现依据表1的标准进行分类。峰形不对称性用于评估柱惰性程度;线性评估采用 R² 与 %RSD 指标;回收率在最低校准点(LCP)及 50 ppb 中点浓度下测定;回收率的重复亦在 50 ppb 下进行评估。
表1.数据质量分类
| 理想 | 理想 | 可接受 | 较差 |
|---|---|---|---|
| 峰对称性 | 0.9-1.2 | 0.5-0.9 or 1.2-2 | <0.5, >2 |
| 线性 (R²) | >0.995 | 0.990-0.995 | <0.990 |
| 线性 (%RSD) | <10% | 11-20% | >20% |
| 回收率(最低校准点,LCP) | 70-130% | 50-69% or 131-200% | <50%, >200% |
| 回收率(50 ppb) | 70-130% | 50-69% or 131-200% | <50%, >200% |
| 重复性(50 ppb %RSD) | <10% | 11-20% | >20% |
结果与讨论
色谱柱色谱性能
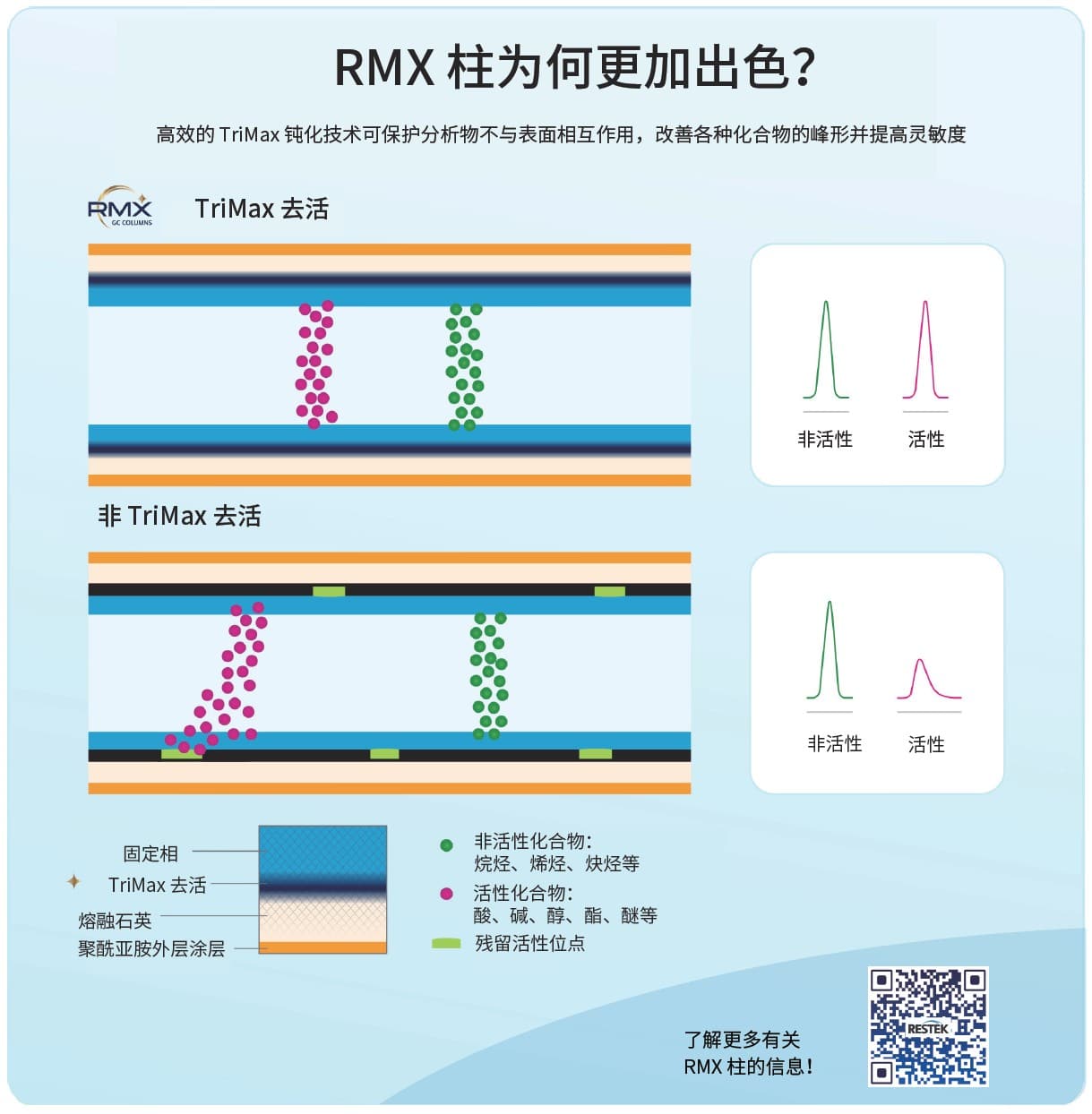
硅醇基团是 GC 色谱柱的熔融石英表面上常见的活性位点来源,这种柱表面的活性位点可能与分析物发生非特异性相互作用,导致峰拖尾、保留时间漂移及灵敏度下降等问题。因此,柱制造商通常采用不同的去活处理方式以降低这类影响。然而,若钝化不彻底,酸性化合物(如酚类)可通过氢键与硅醇结合,而碱性化合物(如联苯胺)则可能通过酸碱相互作用与柱表面结合,从而干扰定量分析。半挥发性化合物分析的复杂性在于其涵盖广泛化学类别,且不同类别与柱表面的相互作用机制和强度差异显著,因此柱的钝化必须具备广范围的有效性以确保分析可靠性。
为更有效抑制硅醇活性,Restek 开发了将应用于所有 RMX 柱系列的新一代 TriMax 去活技术,该技术通过在聚合物-熔融石英界面构建稳固聚合物层,显著降低表面硅醇活性,从而避免分析物与硅醇的相互作用。如图 1 所示,RMX-5Sil MS 柱在包括 2,4-二硝基酚、五氯酚及联苯胺等分析难点化合物在内的广泛半挥发性化合物中,均峰形尖锐、对称,表现出良好的色谱性能。
如图 1 所示,在用于比较分析的标准化条件下,RMX-5Sil MS 柱上的各种半挥发物获得了极好的峰形。(有关优化条件,请参阅我们针对 150 种半挥发物的低浓度分析方法[1]。)
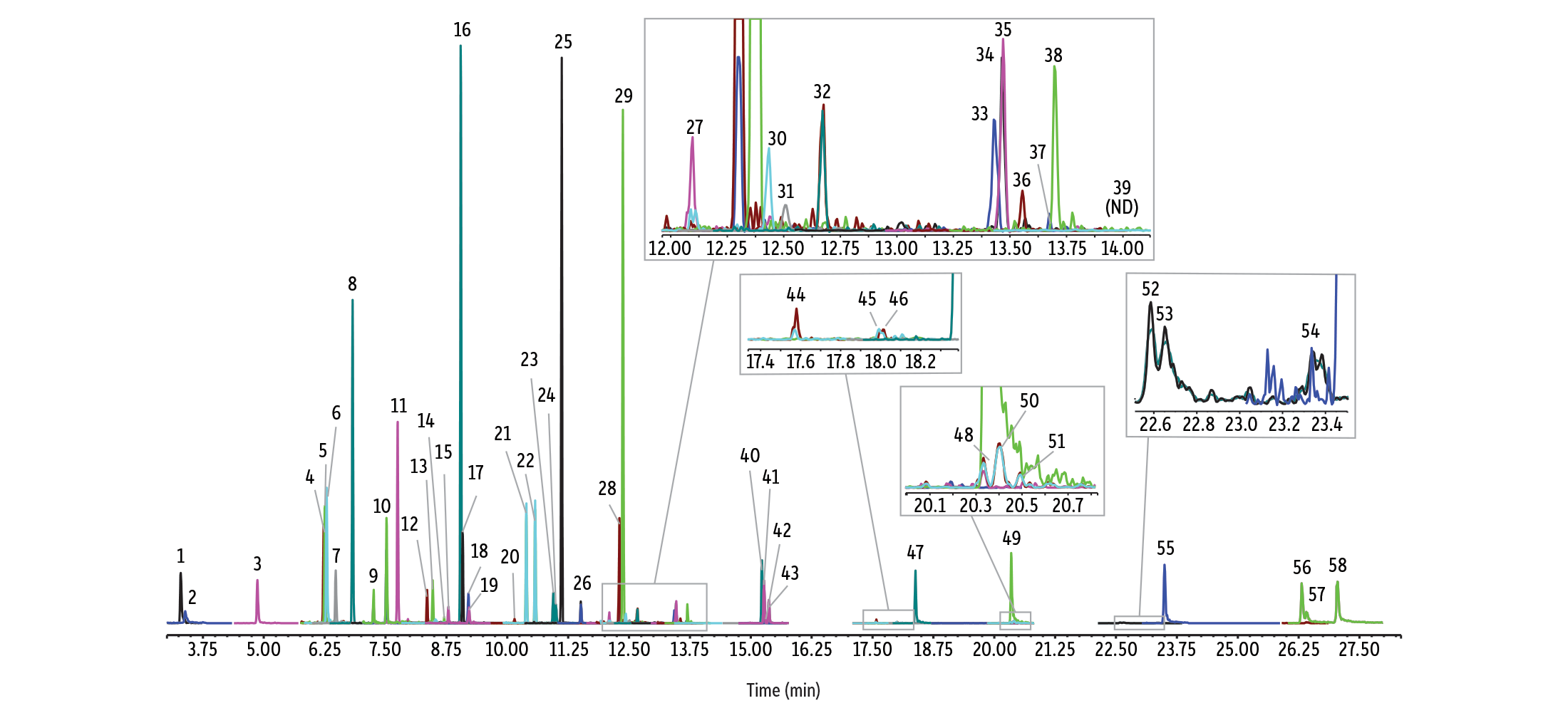
GC_EV1528
Peaks
| Peaks | tR (min) | Conc. (ng/mL) | Mass 1 | Product 1 | Collision energy 1 | Mass 2 | Product 2 | Collision energy 2 | |
|---|---|---|---|---|---|---|---|---|---|
| 1. | N-Nitrosodimethylamine | 3.55 | 50 | 74 | 44 | 6 | 74 | 42 | 16 |
| 2. | Pyridine | 3.59 | 50 | 79 | 51 | 26 | 52 | 26 | 18 |
| 3. | 2-Fluorophenol | 5.03 | 50 | 112 | 92 | 6 | 92 | 63 | 14 |
| 4. | Phenol-d6 | 6.37 | 50 | 99 | 71 | 8 | 99 | 69 | 18 |
| 5. | Phenol | 6.40 | 50 | 94 | 66 | 10 | 94 | 65 | 16 |
| 6. | Aniline | 6.45 | 50 | 93 | 66 | 10 | 93 | 65 | 20 |
| 7. | 2-Chlorophenol | 6.62 | 50 | 128 | 64 | 14 | 128 | 63 | 24 |
| 8. | 1,4-Dichlorobenzene-d4 | 6.96 | 100 | 150 | 115 | 14 | 150 | 78 | 26 |
| 9. | 2-Methylphenol | 7.38 | 50 | 108 | 80 | 8 | 108 | 77 | 24 |
| 10. | 3- and 4-Methylphenol | 7.66 | 50 | 70 | 43 | 6 | 107 | 77 | 14 |
| 11. | Nitrobenzene-d5 | 7.89 | 50 | 128 | 82 | 12 | 128 | 54 | 28 |
| 12. | 2-Nitrophenol | 8.54 | 50 | 139 | 81 | 12 | 139 | 109 | 8 |
| 13. | 2,4-Dimethylphenol | 8.61 | 50 | 122 | 107 | 12 | 122 | 77 | 20 |
| 14. | Benzoic acid | 8.72 | 50 | 122 | 105 | 8 | 122 | 77 | 20 |
| 15. | 2,4-Dichlorophenol | 8.95 | 50 | 162 | 63 | 24 | 162 | 98 | 12 |
| 16. | Naphthalene-d8 | 9.18 | 100 | 136 | 134 | 14 | 136 | 108 | 18 |
| 17. | Naphthalene | 9.23 | 50 | 128 | 102 | 16 | 129 | 103 | 14 |
| 18. | 4-Chloroaniline | 9.35 | 50 | 127 | 100 | 10 | 127 | 65 | 20 |
| 19. | 2,6-Dichlorophenol | 9.37 | 50 | 162 | 63 | 24 | 164 | 63 | 26 |
| 20. | 4-Chloro-3-methylphenol | 10.28 | 50 | 142 | 107 | 12 | 107 | 77 | 12 |
| 21. | 2-Methylnaphthalene | 10.53 | 50 | 141 | 115 | 16 | 141 | 89 | 30 |
| 22. | 1-Methylnaphthalene | 10.71 | 50 | 141 | 115 | 16 | 141 | 89 | 30 |
| 23. | 2,4,6-Trichlorophenol | 11.09 | 50 | 132 | 97 | 10 | 196 | 97 | 24 |
| 24. | 2,4,5-Trichlorophenol | 11.09 | 50 | 132 | 97 | 10 | 196 | 97 | 24 |
| 25. | 2-Fluorobiphenyl | 11.26 | 50 | 172 | 171 | 12 | 172 | 170 | 22 |
| 26. | o-Nitroaniline | 11.66 | 50 | 138 | 92 | 12 | 138 | 65 | 22 |
| 27. | Acenaphthylene | 12.24 | 50 | 152 | 102 | 26 | 152 | 76 | 36 |
| 28. | 3-Nitroaniline | 12.49 | 50 | 138 | 92 | 12 | 138 | 65 | 20 |
| 29. | Acenaphthene-d10 | 12.53 | 100 | 162 | 160 | 18 | 164 | 162 | 14 |
| 30. | Acenaphthene | 12.60 | 50 | 153 | 126 | 36 | 153 | 77 | 38 |
| 31. | 2,4-Dinitrophenol | 12.70 | 50 | 184 | 154 | 6 | 154 | 79 | 12 |
| 32. | 4-Nitrophenol | 12.90 | 50 | 139 | 109 | 6 | 139 | 81 | 14 |
| 33. | 2,3,4,6-Tetrachlorophenol | 13.21 | 50 | 232 | 168 | 12 | 234 | 131 | 24 |
| 34. | 4-Nitroaniline | 13.60 | 50 | 138 | 108 | 8 | 138 | 80 | 18 |
| 35. | Fluorene | 13.61 | 50 | 165 | 115 | 24 | 165 | 139 | 26 |
| 36. | 4,6-Dinitro-2-methylphenol | 13.71 | 50 | 198 | 168 | 6 | 198 | 121 | 10 |
| 37. | Diphenylamine | 13.88 | 50 | 169 | 66 | 22 | 170 | 66 | 22 |
| 38. | 2,4,6-Tribromophenol | 14.10 | 50 | 330 | 141 | 36 | 332 | 143 | 34 |
| 39. | Pentachlorophenol | 15.04 | 50 | 228 | 165 | 14 | 270 | 169 | 22 |
| 40. | Phenanthrene-d10 | 15.40 | 100 | 188 | 160 | 20 | 184 | 156 | 22 |
| 41. | Phenanthrene | 15.46 | 50 | 178 | 152 | 18 | 178 | 151 | 32 |
| 42. | Dinoseb | 15.49 | 50 | 163 | 116 | 14 | 240 | 211 | 8 |
| 43. | Anthracene | 15.54 | 50 | 178 | 152 | 18 | 177 | 151 | 18 |
| 44. | Fluoranthene | 17.78 | 50 | 202 | 176 | 26 | 202 | 152 | 30 |
| 45. | Benzidine | 18.05 | 50 | 184 | 156 | 18 | 184 | 166 | 16 |
| 46. | Pyrene | 18.20 | 50 | 200 | 174 | 22 | 200 | 149 | 34 |
| 47. | p-Terphenyl-d14 | 18.57 | 50 | 244 | 242 | 14 | 244 | 240 | 22 |
| 48. | 3,3′-Dichlorobenzidine | 20.53 | 50 | 252 | 154 | 26 | 252 | 181 | 22 |
| 49. | Chrysene-d12 | 20.55 | 100 | 240 | 238 | 14 | 240 | 236 | 30 |
| 50. | Benz[a]anthracene | 20.63 | 50 | 228 | 202 | 22 | 226 | 200 | 28 |
| 51. | Chrysene | 20.63 | 50 | 228 | 202 | 22 | 228 | 201 | 36 |
| 52. | Benzo[b]fluoranthene | 22.90 | 50 | 252 | 226 | 22 | 250 | 224 | 24 |
| 53. | Benzo[k]fluoranthene | 22.91 | 50 | 252 | 226 | 22 | 250 | 224 | 24 |
| 54. | Benzo[a]pyrene | 23.66 | 50 | 252 | 226 | 22 | 250 | 224 | 26 |
| 55. | Perylene-d12 | 23.81 | 100 | 264 | 262 | 20 | 264 | 260 | 34 |
| 56. | Indeno[1,2,3-cd]pyrene | 26.74 | 50 | 276 | 274 | 38 | 276 | 250 | 30 |
| 57. | Dibenz[a,h]anthracene | 26.80 | 50 | 139 | 126 | 8 | 139 | 113 | 14 |
| 58. | Benzo[ghi]perylene | 27.47 | 50 | 276 | 274 | 38 | 138 | 125 | 12 |
Conditions
| Column | RMX-5Sil MS, 30 m, 0.25 mm ID, 0.25 µm (cat.# 17323) |
|---|---|
| Standard/Sample | |
| 8270 Calibration mix #1 (cat.# 31618) | |
| 8270 Calibration mix #2 (cat.# 31619) | |
| 8270 Calibration mix #5 (cat.# 31995) | |
| Base neutral surrogate mix (4/89 SOW) (cat.# 31024) | |
| Acid surrogate mix (4/89 SOW) (cat.# 31025) | |
| Revised SV internal standard mix (cat.# 31886) | |
| Diluent: | Dichloromethane |
| Conc.: | 50 ppb (100 ppb internal standards) |
| Injection | |
| Inj. Vol.: | 1 µL split (split ratio 5:1) |
| Liner: | Topaz 4.0 mm ID Precision liner w/wool (cat.# 23267) |
| Inj. Temp.: | 250 °C |
| Split Vent Flow Rate: | 6 mL/min |
| Oven | |
| Oven Temp.: | 40 °C (hold 1 min) to 280 °C at 12.4 °C/min to 315 °C at 3.3 °C/min (hold 1 min) |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1.2 mL/min @ 40 °C |
| Detector | SRM/MRM |
|---|---|
| Acquisition Type: | SRM/MRM |
| Source Temp.: | 330 °C |
| Transfer Line Temp.: | 280 °C |
| Analyzer Type: | Triple Quadrupole |
| Ionization Mode: | EI |
| Collision Gas: | Ar |
| Tune Type: | PFTBA |
| Tune Emission Current: | 70 μA |
| Instrument | Thermo Scientific TSQ 8000 Triple Quadrupole GC-MS |
| Sample Preparation | Standards were combined and diluted to a concentration of 50 ppb with internal standards added at 100 ppb. |
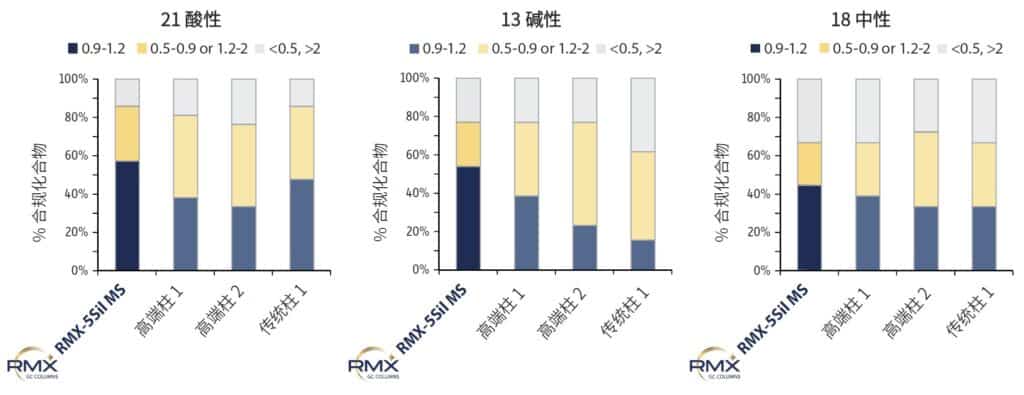
在 50 ppb 浓度水平下,采用标准化条件对 RMX-5Sil MS 柱与其他常用半挥发物分析柱的峰形不对称性进行了比较,评估其惰性。选择中点浓度进行评估,可有效避免低浓度峰拖尾融入基线而掩盖真实差异。结果显示(图 2),在酸性、碱性及中性半挥发性化合物中,RMX-5Sil MS 柱获得了更多理想峰形结果,尤其在酸性和碱性化合物上表现显著优于其他柱,可在单个运行中更准确地定性定量更多类别的半挥发物,为实验室方法整合提供了可行性。
图 2:不对称性评价表明,具有极高惰性的 RMX-5Sil MS 色谱柱在分析酸性、碱性及中性半挥发性化合物时,其峰型表现优于其他分析柱,呈现出理想的峰形
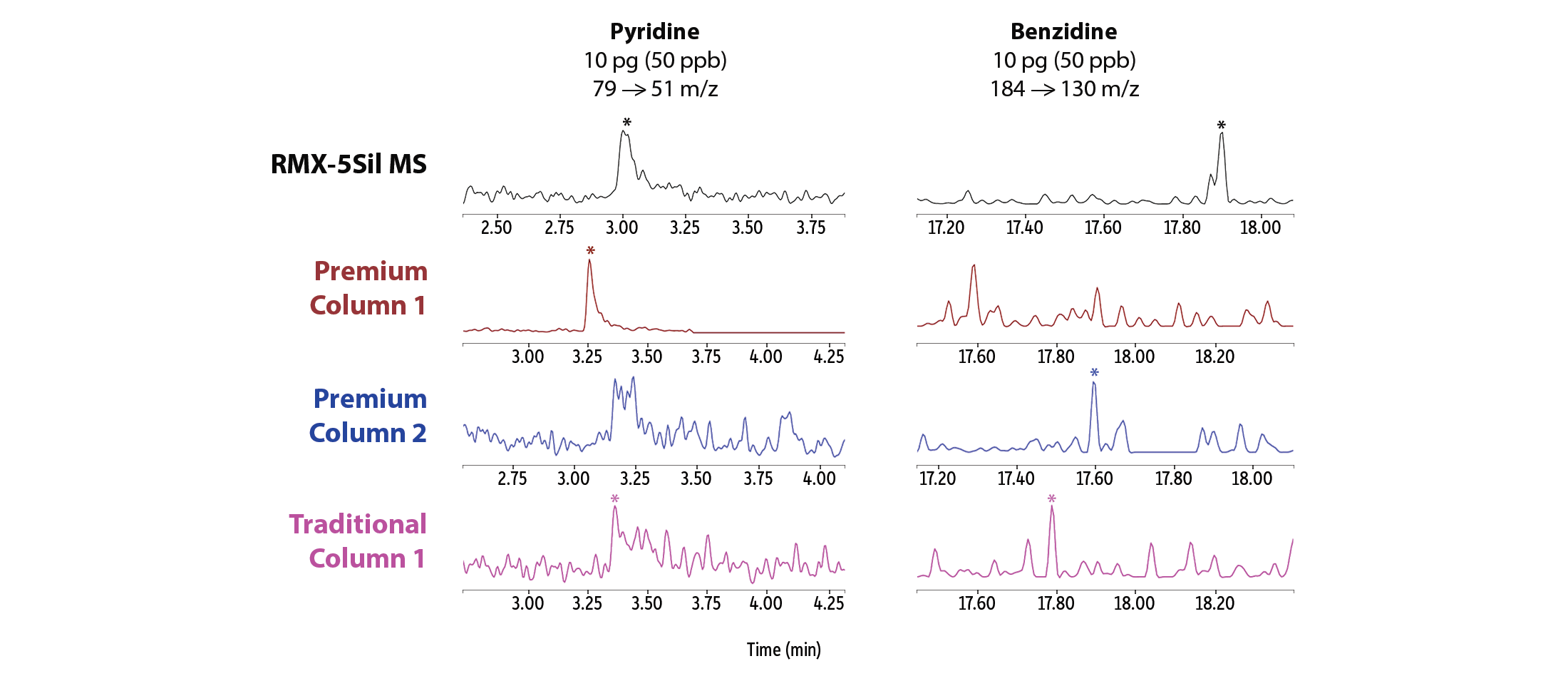
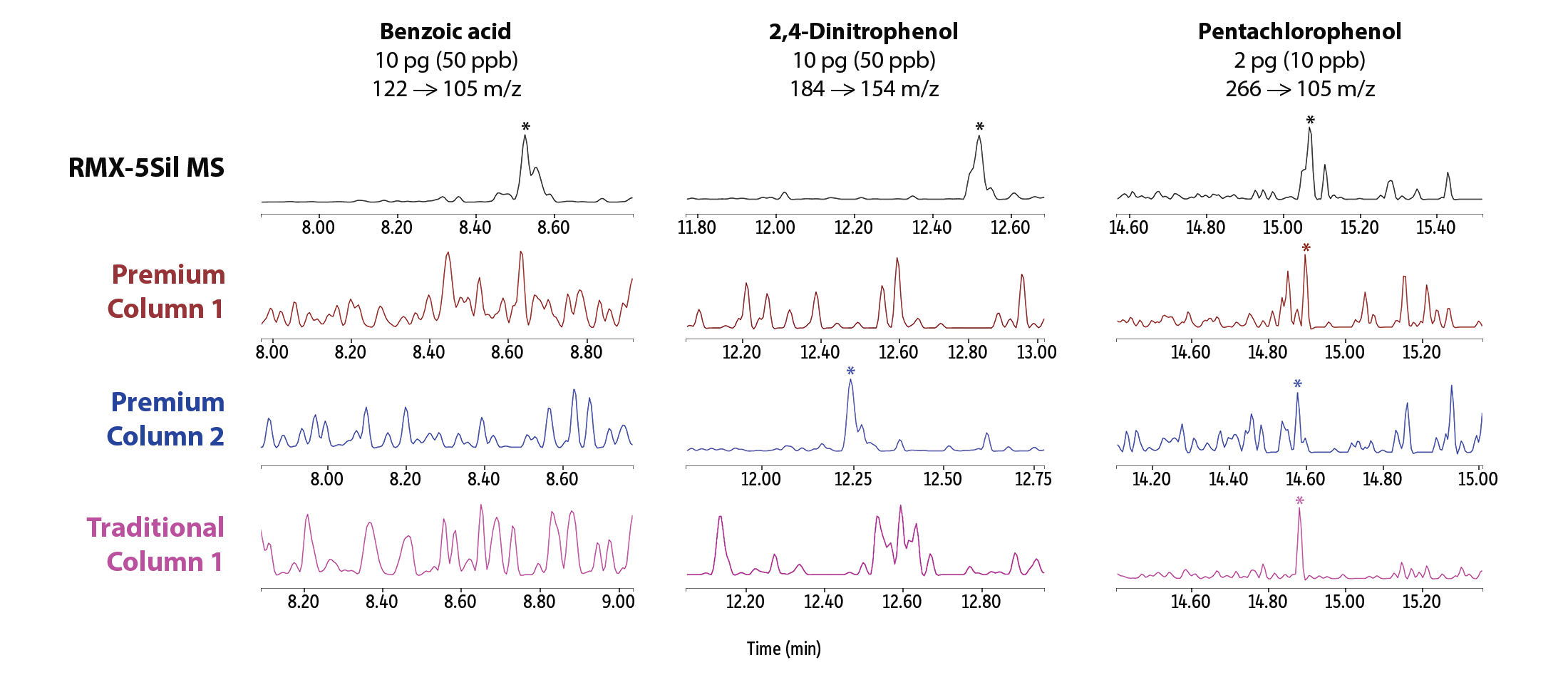
此外,在极低浓度水平下,RMX-5Sil MS 柱在一系列分析难点化合物中均显示出更对称的峰形,更高的峰信号(图 3),使峰积分更可靠,便于软件自动积分。例如,在吡啶、联苯胺、苯甲酸、2,4-二硝基酚及五氯酚分析中,RMX-5Sil MS 柱均获得了高质量峰信号,而竞品柱在部分化合物上虽表现尚可,但在其他化合物上性能明显受限。峰形直观差异进一步证明,TriMax钝化对活性位点的抑制的有效范围远优于传统柱钝化方法。
图 3:具有广泛惰性的 RMX-5Sil MS 色谱柱,在最低校准浓度点(柱上皮克克级)下,仍能对多种活性较高的难分析组分产生稳定
且良好的峰信号
碱性化合物
酸性化合物
校准线性
峰形对称性改善了峰积分精度,进而提升信噪比,使低浓度下的线性校准成为可能。在 RMX-5Sil MS 柱上建立了各半挥发性化合物的线性校准范围(表2),校准点数量为 5‒11 个,最低校准浓度为 0.5‒100 ppb(柱上 0.1‒20 pg)。校准线性高度依赖峰积分,故各柱积分参数保持一致。峰拖尾严重时,可能需手动积分,增加分析人员工作量。虽然可采用加权线性或二次曲线等模型,但理想校准仍以线性模型为准。采用线性校准模型可更清晰地体现峰积分对定量精度的重要性,但最低线性校准点并不等同于最低检测限。
表 2:各半挥发性化合物的校准范围及校准点数
| 化合物名称 | 最低浓度 (ppb) | 最高浓度 (ppb) | 校准点数 |
|---|---|---|---|
| N-二甲基亚硝 | 2 | 1000 | 8 |
| 吡啶5 | 50 | 2000 | 6 |
| 2-氟苯酚 | 0.5 | 20 | 6 |
| 苯酚-d6 | 2 | 200 | 6 |
| 苯酚 | 2 | 200 | 5 |
| 苯胺 | 2 | 200 | 6 |
| 2-氯苯酚 | 0.5 | 200 | 7 |
| 2-甲基苯酚 | 5 | 200 | 6 |
| 3-甲基苯酚与 4-甲基苯酚 | 2 | 1000 | 8 |
| 硝基苯-d5 | 5 | 1000 | 6 |
| 2-硝基苯酚 | 5 | 200 | 5 |
| 2,4-二甲基苯酚 | 2 | 200 | 6 |
| 苯甲酸 | 100 | 2000 | 5 |
| 2,4-二氯苯酚 | 2 | 2000 | 9 |
| 萘 | 1 | 50 | 5 |
| 2,6-二氯苯酚 | 1 | 100 | 5 |
| 4-氯苯胺 | 2 | 200 | 6 |
| 4-氯-3-甲基苯酚 | 5 | 2000 | 8 |
| 2-甲基萘 | 1 | 2000 | 10 |
| 1-甲基萘 | 1 | 2000 | 10 |
| 2,4,6-三氯苯酚 | 5 | 1000 | 7 |
| 2,4,5-三氯苯酚 | 10 | 2000 | 8 |
| 2-氟联苯 | 0.5 | 2000 | 11 |
| 邻-硝基苯胺 | 1 | 100 | 6 |
| 苊烯 | 5 | 200 | 5 |
| 3-硝基苯胺 | 2 | 100 | 6 |
| 苊 | 5 | 2000 | 7 |
| 2,4-二硝基苯酚 | 50 | 2000 | 6 |
| 4-硝基苯酚 | 5 | 2000 | 8 |
| 2,3,4,6-四氯苯酚 | 10 | 2000 | 7 |
| 芴 | 5 | 2000 | 9 |
| 4-硝基苯胺 | 2 | 200 | 6 |
| 4,6-二硝基-2-甲基苯酚 | 5 | 100 | 5 |
| 二苯胺 | 5 | 200 | 5 |
| 2,4,6-三溴苯酚 | 20 | 2000 | 7 |
| 五氯苯酚 | 10 | 1000 | 6 |
| 菲 | 1 | 200 | 7 |
| 地乐酚 | 10 | 200 | 5 |
| 蒽 | 5 | 200 | 6 |
| 荧蒽 | 10 | 200 | 5 |
| 联苯胺 | 50 | 2000 | 5 |
| 芘 | 5 | 100 | 5 |
| 对三联苯-d14 | 1 | 200 | 7 |
| 3,3′-二氯联苯胺 | 20 | 200 | 5 |
| 苯并[a]蒽 | 20 | 500 | 5 |
| 屈 | 10 | 1000 | 5 |
| 苯并[b]荧蒽 | 20 | 1000 | 5 |
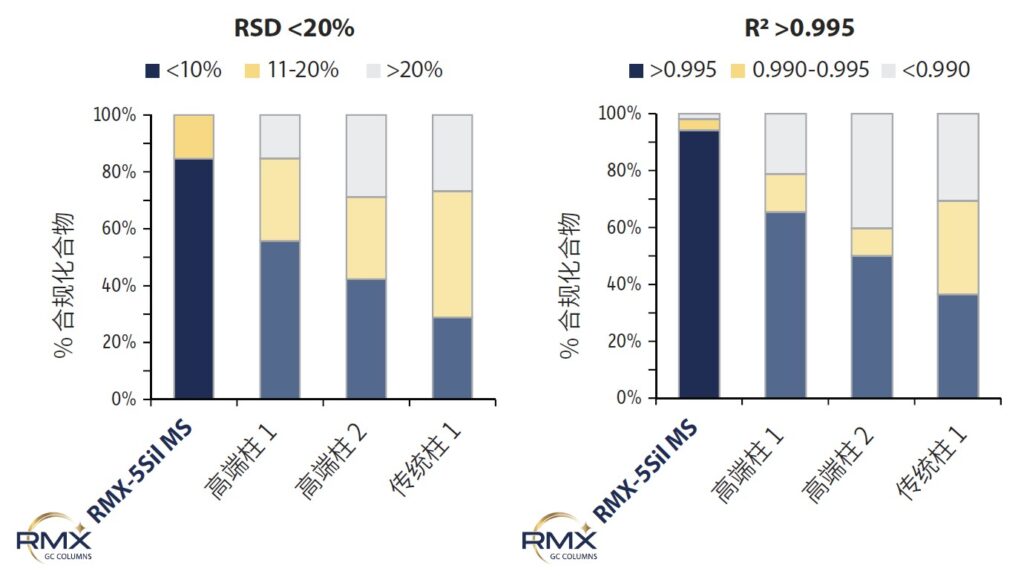
在 RMX-5Sil MS 柱上建立校准曲线后,将同一校准范围及积分参数应用于其他柱,并通过 R²(无权重)及响应因子 %RSD 评估线性拟合。结果显示,RMX-5Sil MS 柱在更多化合物上获得符合方法要求的线性校准(图 4),其优异的 R² 和 %RSD 值表明整体校准线性更佳,从而提升定量精密度和准确性。
图 4:在 RMX-5Sil MS 色谱柱上,更多半挥发性化合物满足数据质量要求(R² > 0.995 且相对标准偏差 <10%),显示出优异的校准线性优越性,相较于其他色谱柱表现更佳
回收率与重复性
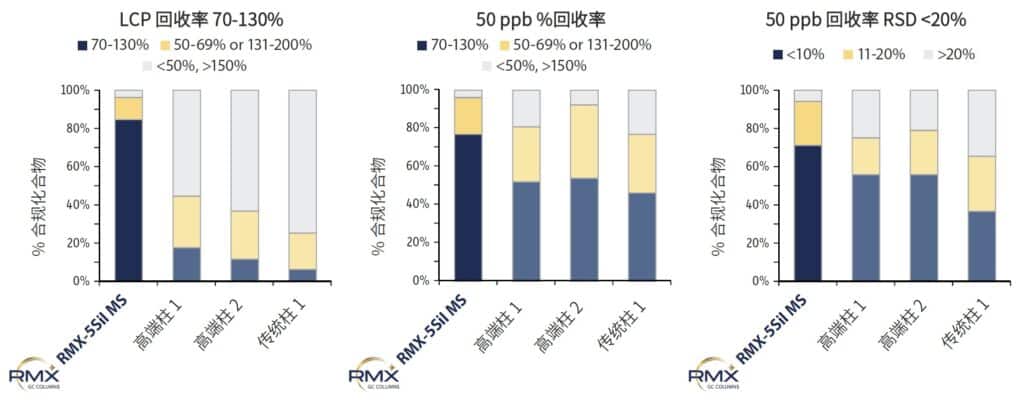
回收率在最低校准点及 50 ppb 中点水平测定,以评估柱选择对分析结果的影响。50 ppb 中点水平的重复性测试更能真实反映柱性能,因为最低校准点的峰形更易受仪器基线噪声影响。结果显示(图 5),RMX-5Sil MS 柱在最低校准点的回收率显著优于其他柱,这归因于其高效的钝化提升了痕量分析峰响应和积分精度。在 50 ppb 中点水平,各柱回收率差异较小,但RMX-5Sil MS 柱表现出更高的一致性。回收率重复性依赖峰形与积分算法之间的关系,而 RMX-5Sil MS 柱获得的高度稳定结果表明,其 TriMax 钝化显著降低了表面活性引起的分析变异。
图 5:RMX-5Sil MS 色谱柱在最低校准浓度点(LCP)及 50 ppb 条件下,达到 70‒130% 回收率的化合物数量最多。此外,该色谱柱在 50 ppb 时表现出高度一致性,并且达到相对标准偏差 <10% 的化合物数量也最多
结论
尽管 5 型及 5sil 型柱在半挥发性化合物分析中具有合适选择性并被广泛采用,传统钝化方法仍无法完全消除活性位点,导致分析痕量活性化合物存在困难,且在需多柱分析不同类别分析物或质量标准无法满足时,实验室生产效率可能下降。本研究对比分析表明,RMX-5Sil MS 柱所采用的 TriMax 钝化技术显著增强了色谱柱的惰性,在不同化合物类别中均表现出卓越性能。在使用 RMX-5Sil MS 柱时,相较于其他的分析柱,它可以在更多半挥发性化合物上实现数据质量目标,并且对酸性、碱性、及中性化合物均表现优异,为实验室降低溶剂消耗、整合分析方法提供了更大潜力,相较传统 5 型柱具有显著优势。
参考文献
- E. Pack、C. English、R. Dhandapani 与 C. Myers,通过整合痕量半挥发性化合物分析的方法提升实验室效率,特色应用笔记,EVFA5253,Restek 公司,2025 年。 https://discover.restek.com/articles/evfa5253/increase-lab-efficiency-with-an-expanded-trace-level-semivolatiles-method