Punti Chiave
- La deattivazione TriMax di nuova generazione crea un percorso di flusso del campione robusto ed eccezionalmente neutro.
- La massima inerzia migliora la forma dei picchi per un’ampia gamma di semivolatili, consentendo intervalli di calibrazione più bassi e una sensibilità a livello di picogrammo.
- Le ottime prestazioni della colonna supportano elenchi di analiti più ampie la riduzione dei volumi di estrazione del campione.


Abstract
Il presente studio esamina l’impatto di una rivoluzionaria tecnologia di deattivazione TriMax sull’analisi GC-MS/MS dei composti semivolatili.
Le prestazioni di quattro colonne analitiche comunemente utilizzate sono state confrontate mediante test di asimmetria dei picchi, linearità di calibrazione, recupero e ripetibilità, su un’ampia gamma di composti chimici. I risultati mostrano che, contrariamente ad altre colonne che soddisfano i criteri solo per specifiche classi di composti, le colonne RMX-5Sil MS, realizzate con una nuova tecnologia di deattivazione TriMax, presentano una superficie significativamente più inerte, che soddisfa i criteri di prestazione per semivolatili acidi, basici e neutri. Le prestazioni competitive su un’ampia gamma di semivolatili a bassi livelli consentono ai laboratori di ottimizzare le operazioni attraverso protocolli di estrazione del campione ridotti o il consolidamento dei metodi. La tecnologia di deattivazione TriMax utilizzata nelle colonne RMX-5Sil MS ha consentito di superare i problemi di attività che, come è stato dimostrato, influiscono sulle prestazioni quantitative complessive delle colonne della concorrenza.
Introduzione
I composti organici semivolatili (SVOC) presenti nell’ambiente sono monitorati su scala globale a causa della loro diffusione e dei rischi che rappresentano per la salute umana. I metodi GC-MS e GC-MS/MS sono approcci comunemente utilizzati per l’analisi dei semivolatili nei campioni ambientali e, grazie alla maggiore sensibilità della rivelazione
MS/MS, i laboratori possono raggiungere limiti di rilevabilità più bassi e ottenere risparmi di solvente e di tempo riducendo i volumi di estrazione del campione. I metodi di estrazione a volume ridotto sono generalmente più semplici e utilizzano meno solvente (per esempio diclorometano) rispetto ai metodi di estrazione standard. Tuttavia, gli estratti risultano meno concentrati, fattore che sta favorendo l’adozione della GC-MS/MS nei laboratori che mirano a ridurre il consumo di solvente mantenendo al contempo le prestazioni del metodo.
I semivolatili comprendono un’ampia gamma di composti chimici, alcuni dei quali sono noti per interagire con siti attivi (per esempio i silanoli) lungo il percorso di flusso del campione, rendendo difficile una rilevazione affidabile a bassi livelli. Per far fronte a queste
interazioni critiche, i laboratori possono ricorrere a diverse colonne GC in funzione degli analiti target. Le colonne di tipo “5” o “5sil” a media polarità sono quelle più diffuse. Tuttavia, man mano che i laboratori cercano di abbassare i limiti di rilevazione e potenziare la sensibilità delle colonne, diventano più evidenti gli svantaggi dei diversi processi di produzione impiegati per ogni colonna di “tipo 5”. Mentre i composti neutri non sono tipicamente influenzati dai siti attivi rimasti sulla superficie della colonna GC, i composti acidi e basici possono essere sensibili anche alle più lievi differenze superficiali. Con l’inclusione di composti basici (benzidina) e acidi (pentaclorofenolo) nelle verifiche di idoneità del sistema, insieme alla richiesta di curve di calibrazione sempre più sensibili,
i siti attivi sulla superficie delle colonne GC sono sottoposti a un’attenzione sempre maggiore. Le colonne GC caratterizzate da una deattivazione altamente efficace sono particolarmente richieste perché, garantendo migliori prestazioni per semivolatili acidi, basici e neutri, consentono ai laboratori di aumentare produttività e redditività grazie a un minore consumo di solvente, a migliori prestazioni strumentali e maggiori opportunità di consolidamento dei metodi.
Nel presente studio sono state confrontate le prestazioni di diverse colonne GC comunemente impiegate per l’analisi dei semivolatili con le prestazioni delle colonne RMX-5Sil MS. Le colonne RMX-5Sil MS sono sottoposte a un’esclusiva deattivazione della superficie che incorpora la tecnologia TriMax, in grado di generare una deposizione polimerica robusta, eliminare i siti attivi e creare un percorso di flusso del campione eccezionalmente inerte. La colonna RMX-5Sil MS utilizza un polimero 5sil tradizionale, risultando quindi un sostituto diretto delle colonne 5sil, mentre la superficie altamente neutra migliora la forma dei picchi e le prestazioni per un’ampia varietà di composti, permettendo di abbassare i livelli delle curve di calibrazione pur continuando a soddisfare i requisiti di qualità dei dati.
Studio Sperimentale
Preparazione degli Standard e dei Campioni
Gli standard di calibrazione contenenti semivolatili acidi, basici e neutri sono stati preparati in diclorometano in un intervallo di concentrazione compreso tra 0,5 e 5000 ppb, al fine di determinare il più basso intervallo di calibrazione lineare per ciascun analita.
Per ogni colonna sono stati preparati standard di calibrazione freschi. Sono stati inoltre preparati standard per le prove di recupero a concentrazione intermedia a 50 ppb.
Condizioni Strumentali
I campioni sono stati analizzati utilizzando quattro tipi di colonne (RMX-5Sil MS, due colonne premium di produttori concorrenti e una colonna concorrente tradizionale) nel formato 30 m, ID 0,25 mm, 0,25 μm. Per l’analisi dei semivolatili è stato utilizzato un GC Thermo TRACE 1310 accoppiato a uno spettrometro di massa TSQ 8000, alle condizioni riportate di seguito. Le condizioni impiegate sono state semplificate per consentire la standardizzazione e un confronto diretto tra le colonne testate. Nelle applicazioni di routine possono essere impiegate impostazioni diverse dell’iniettore, del forno o del detector per migliorare ulteriormente i risultati cromatografici. Condizioni ottimizzate sono presentate in uno studio separato a bassi livelli di concentrazione, che include un elenco ampliato di 150 semivolatili comunemente analizzati [1].
Volume di iniezione: 1 μL
Liner: Liner per iniettore Precision Topaz, 4 mm, con lana (n° cat. 23267)
Porta di iniezione: 250 °C; split 5:1; 1,2 mL/min.
Carrier gas: elio
Forno: da 40 °C (mantenimento 1 min) a 280 °C a 12,4 °C/min, fino a 315 °C a 3,3 °C/min (mantenimento 1 min)
Detector: MS/MS; modalità SRM; temperatura della linea di trasferimento 280 °C; sorgente 330 °C (vedi Figura 1 per le transizioni SRM)
Valutazione della Qualità dei Dati
La qualità dei dati è stata valutata sulla base di asimmetria, linearità, recupero e ripetibilità; le prestazioni complessive per ciascun parametro sono state classificate secondo i criteri riportati nella Tabella I. L’asimmetria è stata valutata per ciascun composto come misura dell’inerzia. La linearità è stata valutata utilizzando sia il coefficiente R2 sia la %RSD. La percentuale di recupero è stata determinata per ciascun analita al punto di calibrazione più basso (LCP) e a 50 ppb, utilizzato come prova di recupero a concentrazione intermedia. La ripetibilità del recupero è stata anch’essa determinata a 50 ppb.
Tabella I: Classificazioni della qualità dei dati
| Ideale | Accettabile | Scarsa | |
|---|---|---|---|
| Asimmetria | 0.9-1.2 | 0.5-0.9 or 1.2-2 | <0.5, >2 |
| Linearità (R2) | >0.995 | 0.990-0.995 | <0.990 |
| Linearità (%RSD) | <10% | 11-20% | >20% |
| Recupero (LCP) | 70-130% | 50-69% or 131-200% | <50%, >200% |
| Recupero (50 ppb) | 70-130% | 50-69% or 131-200% | <50%, >200% |
| Ripetibilità (%RSD a 50 ppb) | <10% | 11-20% | >20% |
Resultati e Discussione
Prestazioni Cromatografiche
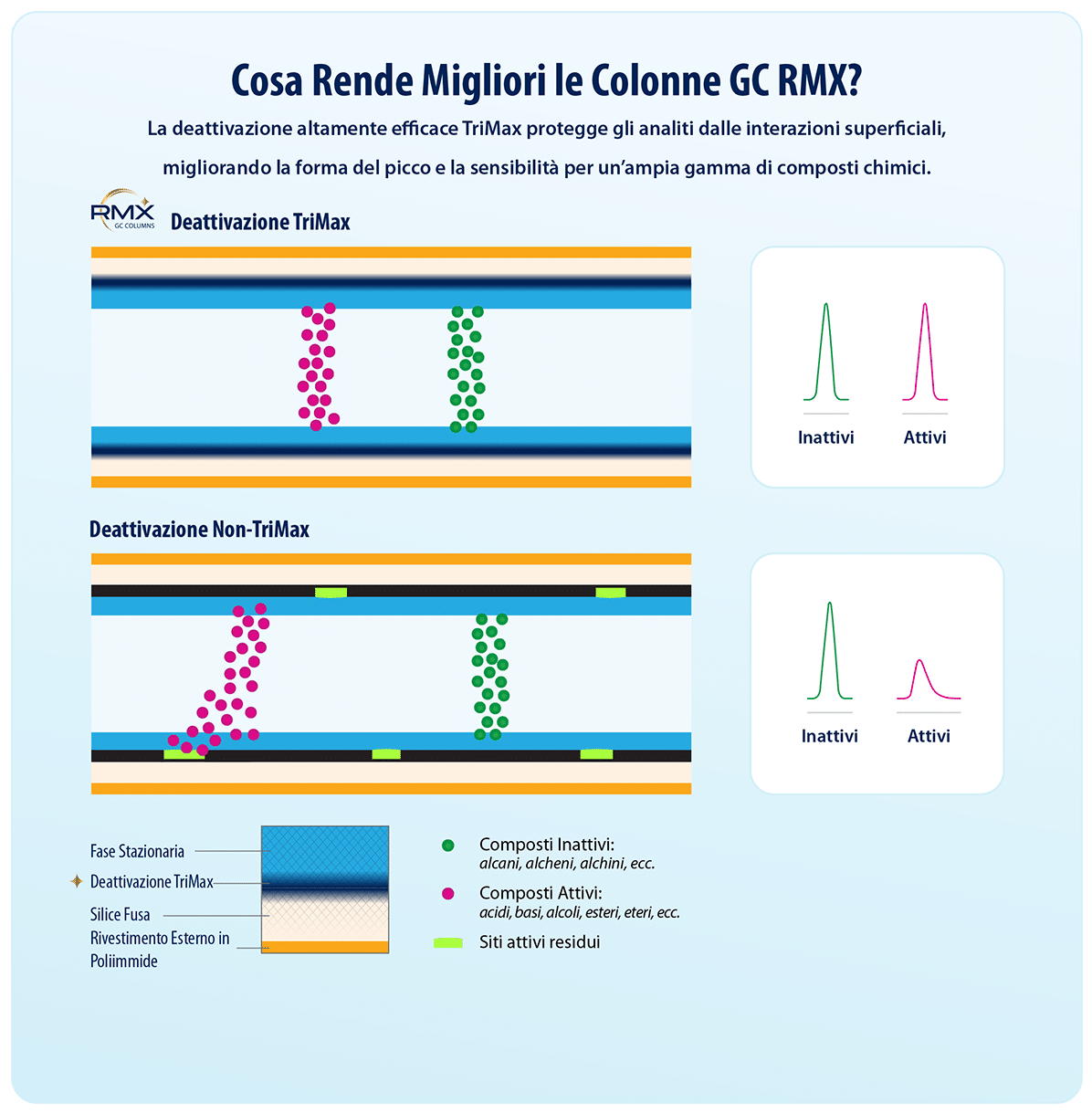
I silanoli rappresentano una fonte comune di siti attivi sulla superficie di silice fusa delle colonne GC; per questo motivo i produttori di colonne adottano diversi trattamenti di deattivazione per ridurne l’impatto. Tuttavia, se la deattivazione non è sufficientemente efficace, l’interazione di un analita con i silanoli può causare una ripartizione incoerente o ritardata dalla fase stazionaria, con conseguente scodamento dei picchi e ulteriori problematiche, quali variazione dei tempi di ritenzione e scarsa sensibilità. I composti acidi, in particolare i fenoli, possono essere trattenuti dai silanoli tramite legami a idrogeno, mentre i composti basici, come le benzidine, possono legarsi alla superficie attraverso interazioni acido–base. Una delle difficoltà nell’analisi dei semivolatili è che essi comprendono un’ampia varietà di classi di composti che interagiscono secondo eccanismi e intensità differenti; di conseguenza, la deattivazione della colonna deve essere efficace su un ampio spettro.
Per contrastare in modo più efficace l’attività dei silanoli, Restek ha sviluppato la deattivazione TriMax di nuova generazione per tutte le colonne RMX, che riduce al minimo l’attività dei silanoli superficiali grazie a una robusta interfaccia polimero–silice fusa, impedendo le interazioni analita–silanolo. Come mostrato in Figura 1, ciò si traduce in eccellenti prestazioni cromatografiche e in picchi netti e simmetrici per un’ampia gamma di semivolatili, inclusi composti notoriamente problematici come il 2,4-dinitrofenolo (2,4-DNP), il pentaclorofenolo e la benzidina.
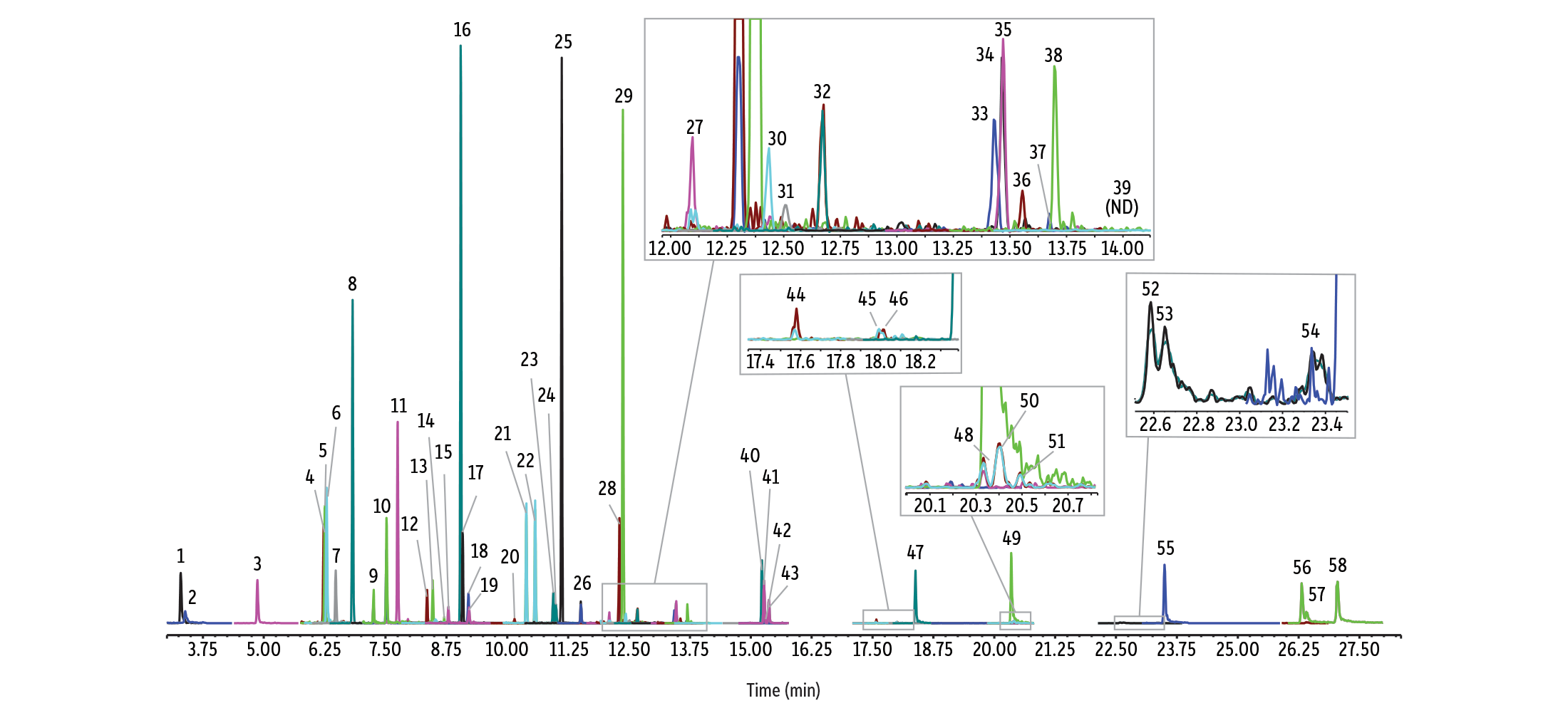
GC_EV1528
Peaks
| Peaks | tR (min) | Conc. (ng/mL) | Mass 1 | Product 1 | Collision energy 1 | Mass 2 | Product 2 | Collision energy 2 | |
|---|---|---|---|---|---|---|---|---|---|
| 1. | N-Nitrosodimethylamine | 3.55 | 50 | 74 | 44 | 6 | 74 | 42 | 16 |
| 2. | Pyridine | 3.59 | 50 | 79 | 51 | 26 | 52 | 26 | 18 |
| 3. | 2-Fluorophenol | 5.03 | 50 | 112 | 92 | 6 | 92 | 63 | 14 |
| 4. | Phenol-d6 | 6.37 | 50 | 99 | 71 | 8 | 99 | 69 | 18 |
| 5. | Phenol | 6.40 | 50 | 94 | 66 | 10 | 94 | 65 | 16 |
| 6. | Aniline | 6.45 | 50 | 93 | 66 | 10 | 93 | 65 | 20 |
| 7. | 2-Chlorophenol | 6.62 | 50 | 128 | 64 | 14 | 128 | 63 | 24 |
| 8. | 1,4-Dichlorobenzene-d4 | 6.96 | 100 | 150 | 115 | 14 | 150 | 78 | 26 |
| 9. | 2-Methylphenol | 7.38 | 50 | 108 | 80 | 8 | 108 | 77 | 24 |
| 10. | 3- and 4-Methylphenol | 7.66 | 50 | 70 | 43 | 6 | 107 | 77 | 14 |
| 11. | Nitrobenzene-d5 | 7.89 | 50 | 128 | 82 | 12 | 128 | 54 | 28 |
| 12. | 2-Nitrophenol | 8.54 | 50 | 139 | 81 | 12 | 139 | 109 | 8 |
| 13. | 2,4-Dimethylphenol | 8.61 | 50 | 122 | 107 | 12 | 122 | 77 | 20 |
| 14. | Benzoic acid | 8.72 | 50 | 122 | 105 | 8 | 122 | 77 | 20 |
| 15. | 2,4-Dichlorophenol | 8.95 | 50 | 162 | 63 | 24 | 162 | 98 | 12 |
| 16. | Naphthalene-d8 | 9.18 | 100 | 136 | 134 | 14 | 136 | 108 | 18 |
| 17. | Naphthalene | 9.23 | 50 | 128 | 102 | 16 | 129 | 103 | 14 |
| 18. | 4-Chloroaniline | 9.35 | 50 | 127 | 100 | 10 | 127 | 65 | 20 |
| 19. | 2,6-Dichlorophenol | 9.37 | 50 | 162 | 63 | 24 | 164 | 63 | 26 |
| 20. | 4-Chloro-3-methylphenol | 10.28 | 50 | 142 | 107 | 12 | 107 | 77 | 12 |
| 21. | 2-Methylnaphthalene | 10.53 | 50 | 141 | 115 | 16 | 141 | 89 | 30 |
| 22. | 1-Methylnaphthalene | 10.71 | 50 | 141 | 115 | 16 | 141 | 89 | 30 |
| 23. | 2,4,6-Trichlorophenol | 11.09 | 50 | 132 | 97 | 10 | 196 | 97 | 24 |
| 24. | 2,4,5-Trichlorophenol | 11.09 | 50 | 132 | 97 | 10 | 196 | 97 | 24 |
| 25. | 2-Fluorobiphenyl | 11.26 | 50 | 172 | 171 | 12 | 172 | 170 | 22 |
| 26. | o-Nitroaniline | 11.66 | 50 | 138 | 92 | 12 | 138 | 65 | 22 |
| 27. | Acenaphthylene | 12.24 | 50 | 152 | 102 | 26 | 152 | 76 | 36 |
| 28. | 3-Nitroaniline | 12.49 | 50 | 138 | 92 | 12 | 138 | 65 | 20 |
| 29. | Acenaphthene-d10 | 12.53 | 100 | 162 | 160 | 18 | 164 | 162 | 14 |
| 30. | Acenaphthene | 12.60 | 50 | 153 | 126 | 36 | 153 | 77 | 38 |
| 31. | 2,4-Dinitrophenol | 12.70 | 50 | 184 | 154 | 6 | 154 | 79 | 12 |
| 32. | 4-Nitrophenol | 12.90 | 50 | 139 | 109 | 6 | 139 | 81 | 14 |
| 33. | 2,3,4,6-Tetrachlorophenol | 13.21 | 50 | 232 | 168 | 12 | 234 | 131 | 24 |
| 34. | 4-Nitroaniline | 13.60 | 50 | 138 | 108 | 8 | 138 | 80 | 18 |
| 35. | Fluorene | 13.61 | 50 | 165 | 115 | 24 | 165 | 139 | 26 |
| 36. | 4,6-Dinitro-2-methylphenol | 13.71 | 50 | 198 | 168 | 6 | 198 | 121 | 10 |
| 37. | Diphenylamine | 13.88 | 50 | 169 | 66 | 22 | 170 | 66 | 22 |
| 38. | 2,4,6-Tribromophenol | 14.10 | 50 | 330 | 141 | 36 | 332 | 143 | 34 |
| 39. | Pentachlorophenol | 15.04 | 50 | 228 | 165 | 14 | 270 | 169 | 22 |
| 40. | Phenanthrene-d10 | 15.40 | 100 | 188 | 160 | 20 | 184 | 156 | 22 |
| 41. | Phenanthrene | 15.46 | 50 | 178 | 152 | 18 | 178 | 151 | 32 |
| 42. | Dinoseb | 15.49 | 50 | 163 | 116 | 14 | 240 | 211 | 8 |
| 43. | Anthracene | 15.54 | 50 | 178 | 152 | 18 | 177 | 151 | 18 |
| 44. | Fluoranthene | 17.78 | 50 | 202 | 176 | 26 | 202 | 152 | 30 |
| 45. | Benzidine | 18.05 | 50 | 184 | 156 | 18 | 184 | 166 | 16 |
| 46. | Pyrene | 18.20 | 50 | 200 | 174 | 22 | 200 | 149 | 34 |
| 47. | p-Terphenyl-d14 | 18.57 | 50 | 244 | 242 | 14 | 244 | 240 | 22 |
| 48. | 3,3′-Dichlorobenzidine | 20.53 | 50 | 252 | 154 | 26 | 252 | 181 | 22 |
| 49. | Chrysene-d12 | 20.55 | 100 | 240 | 238 | 14 | 240 | 236 | 30 |
| 50. | Benz[a]anthracene | 20.63 | 50 | 228 | 202 | 22 | 226 | 200 | 28 |
| 51. | Chrysene | 20.63 | 50 | 228 | 202 | 22 | 228 | 201 | 36 |
| 52. | Benzo[b]fluoranthene | 22.90 | 50 | 252 | 226 | 22 | 250 | 224 | 24 |
| 53. | Benzo[k]fluoranthene | 22.91 | 50 | 252 | 226 | 22 | 250 | 224 | 24 |
| 54. | Benzo[a]pyrene | 23.66 | 50 | 252 | 226 | 22 | 250 | 224 | 26 |
| 55. | Perylene-d12 | 23.81 | 100 | 264 | 262 | 20 | 264 | 260 | 34 |
| 56. | Indeno[1,2,3-cd]pyrene | 26.74 | 50 | 276 | 274 | 38 | 276 | 250 | 30 |
| 57. | Dibenz[a,h]anthracene | 26.80 | 50 | 139 | 126 | 8 | 139 | 113 | 14 |
| 58. | Benzo[ghi]perylene | 27.47 | 50 | 276 | 274 | 38 | 138 | 125 | 12 |
Conditions
| Column | RMX-5Sil MS, 30 m, 0.25 mm ID, 0.25 µm (cat.# 17323) |
|---|---|
| Standard/Sample | |
| 8270 Calibration mix #1 (cat.# 31618) | |
| 8270 Calibration mix #2 (cat.# 31619) | |
| 8270 Calibration mix #5 (cat.# 31995) | |
| Base neutral surrogate mix (4/89 SOW) (cat.# 31024) | |
| Acid surrogate mix (4/89 SOW) (cat.# 31025) | |
| Revised SV internal standard mix (cat.# 31886) | |
| Diluent: | Dichloromethane |
| Conc.: | 50 ppb (100 ppb internal standards) |
| Injection | |
| Inj. Vol.: | 1 µL split (split ratio 5:1) |
| Liner: | Topaz 4.0 mm ID Precision liner w/wool (cat.# 23267) |
| Inj. Temp.: | 250 °C |
| Split Vent Flow Rate: | 6 mL/min |
| Oven | |
| Oven Temp.: | 40 °C (hold 1 min) to 280 °C at 12.4 °C/min to 315 °C at 3.3 °C/min (hold 1 min) |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1.2 mL/min @ 40 °C |
| Detector | SRM/MRM |
|---|---|
| Acquisition Type: | SRM/MRM |
| Source Temp.: | 330 °C |
| Transfer Line Temp.: | 280 °C |
| Analyzer Type: | Triple Quadrupole |
| Ionization Mode: | EI |
| Collision Gas: | Ar |
| Tune Type: | PFTBA |
| Tune Emission Current: | 70 μA |
| Instrument | Thermo Scientific TSQ 8000 Triple Quadrupole GC-MS |
| Sample Preparation | Standards were combined and diluted to a concentration of 50 ppb with internal standards added at 100 ppb. |
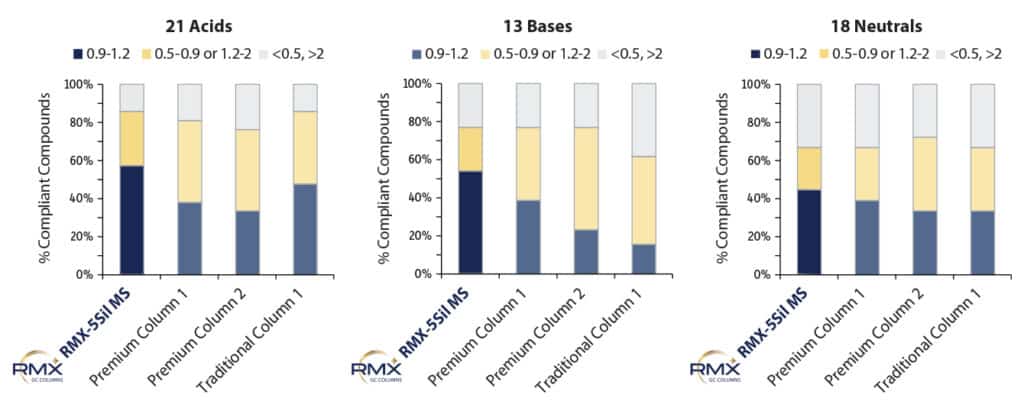
Per confrontare l’inerzia delle colonne RMX-5Sil MS con quella di altre colonne comunemente utilizzate per l’analisi dei semivolatili, è stata valutata l’asimmetria dei picchi in condizioni standardizzate a 50 ppb. Questo livello di concentrazione è stato scelto per
consentire la valutazione dell’asimmetria a un punto intermedio della calibrazione. La valutazione a un livello intermedio compensa le forme di picco con coda pronunciata che, a basse concentrazioni, potrebbero confondersi con la linea di base. La Figura 2 dimostra
che, per i semivolatili acidi, basici e neutri, sulla colonna RMX-5Sil MS sono stati ottenuti risultati ideali per un numero maggiore di composti rispetto a qualsiasi altra colonna testata. La differenza è risultata particolarmente evidente nel caso dei composti acidi e basici, consentendo un’identificazione e una quantificazione più accurate di una gamma più ampia di semivolatili in un’unica analisi, offrendo così ai laboratori opportunità di consolidamento dei metodi.
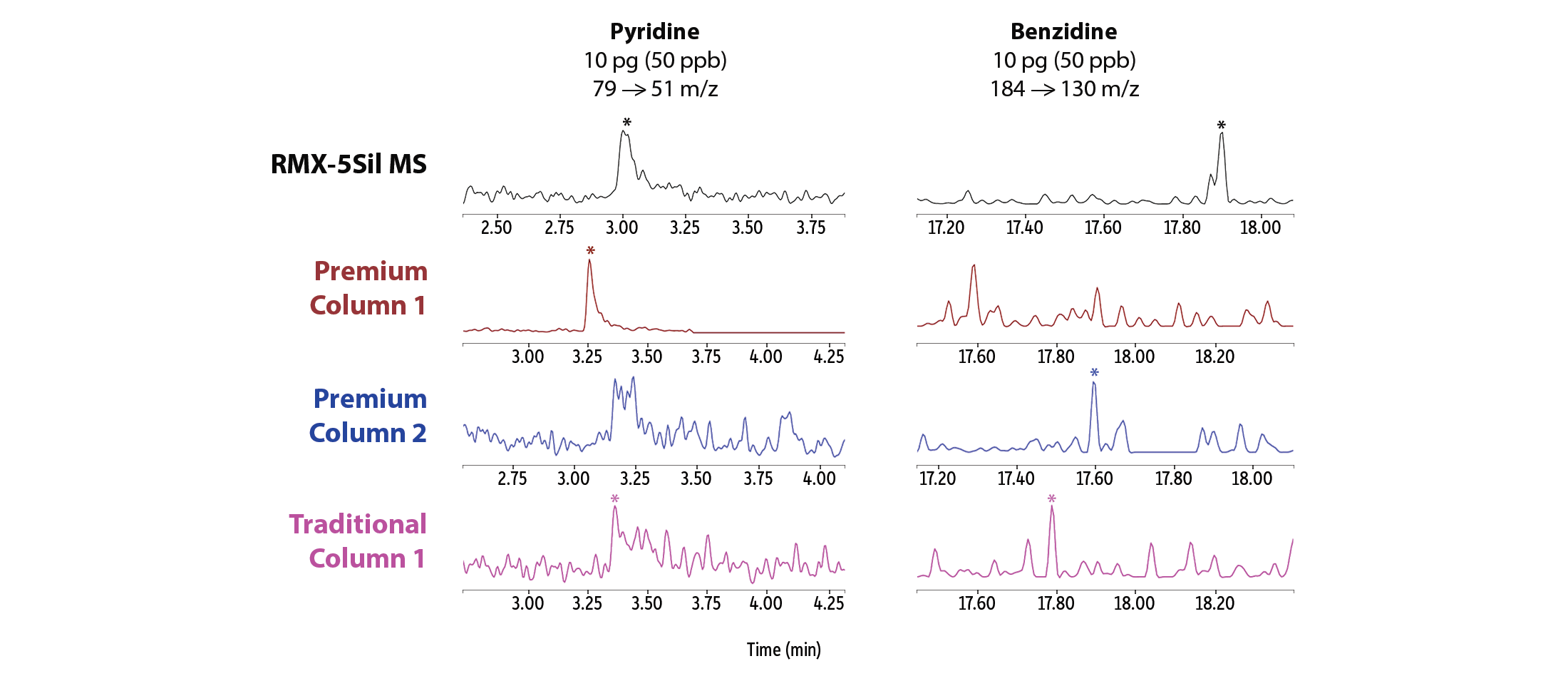
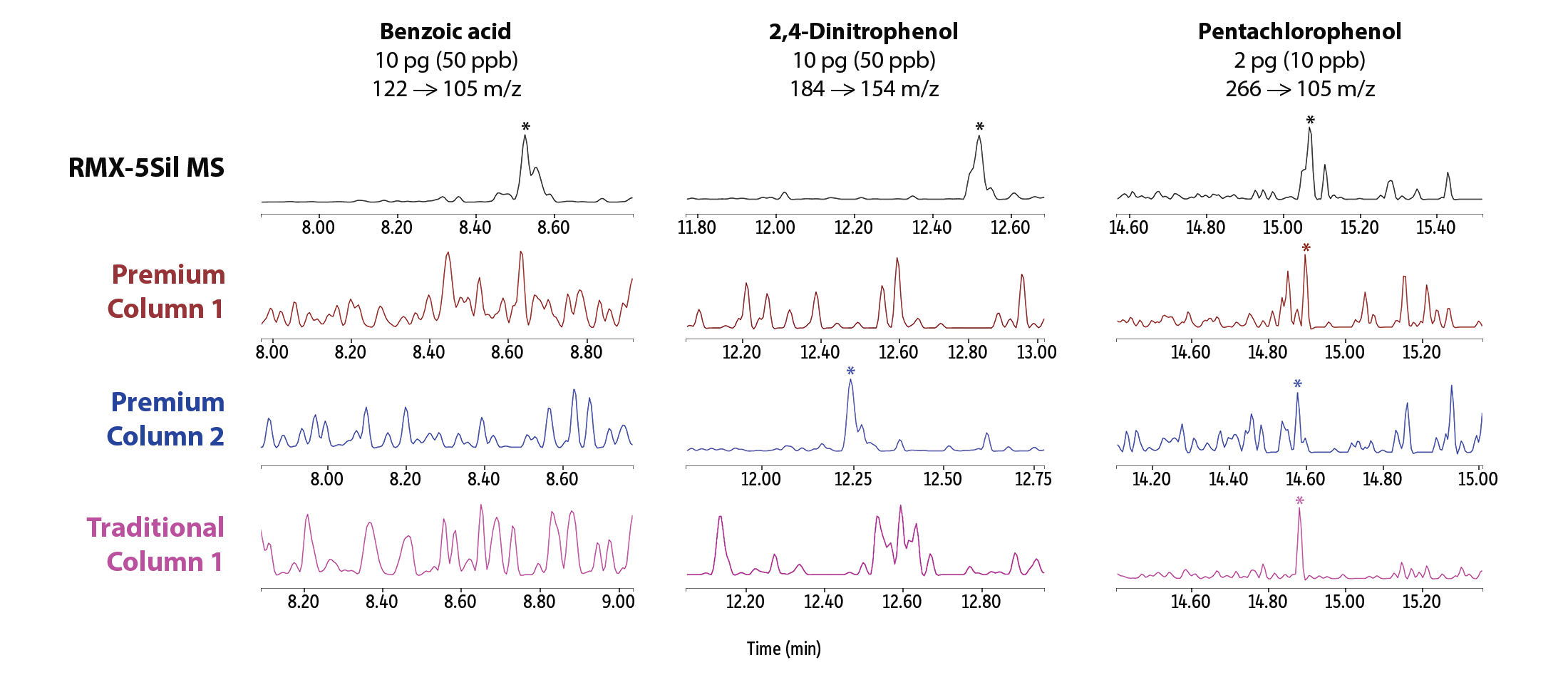
Oltre a un miglioramento generale dell’asimmetria dei picchi, sono stati osservati segnali di picco migliori a livelli di concentrazione molto bassi per una serie di semivolatili noti per essere particolarmente problematici (Figura 3). Sulla colonna RMX-5Sil MS sono stati ottenuti buoni segnali, che consentono una facile integrazione software, per piridina, benzidina, acido benzoico, 2,4-dinitrofenolo e pentaclorofenolo, mentre le colonne concorrenti hanno mostrato prestazioni simili per alcuni composti ma prestazioni significativamente compromesse per altri. Le differenze visive tra le forme dei picchi illustrano come l’inerzia della deattivazione TriMax RMX sia più ampiamente efficace rispetto alle deattivazioni tradizionali utilizzate in altre colonne.
Linearità
Una migliore simmetria dei picchi facilita l’integrazione e aumenta il conseguente rapporto segnale/rumore, consentendo calibrazioni lineari a livelli di concentrazione più bassi. Gli intervalli di calibrazione lineare per ciascun semivolatile sono stati stabiliti sulla
colonna RMX-5Sil MS e sono risultati variabili in funzione dell’analita (Tabella II). Il numero di punti di calibrazione variava da 5 a 11, mentre il livello di calibrazione più basso era compreso tra 0,5 e 100 ppb (0,1-20 pg on-column). Poiché la linearità della calibrazione
è sensibile all’integrazione dei picchi, le impostazioni di integrazione sono state mantenute costanti in ciascuna colonna. Quando i picchi si avvicinano alla linea di base o presentano uno scodamento eccessivo, è necessario provvedere all’integrazione manuale, con conseguente aumento del tempo di analisi per campione. Pur potendo applicare altri modelli di calibrazione, come le curve lineari pesate o le curve quadratiche, la calibrazione lineare rimane la soluzione ideale. Utilizzando un modello lineare per ciascun analita, il ruolo dell’integrazione dei picchi diventa ancora più critico. È comunque opportuno sottolineare che il punto di calibrazione lineare più basso non è necessariamente rappresentativo del limite di rilevazione più basso.
Tabella II: Intervallo di calibrazione e numero di punti di calibrazione per ciascun composto semivolatile
| Nome | Min (ppb) | Max (ppb) | #Punti |
|---|---|---|---|
| N-Nitrosodimethylamine | 2 | 1000 | 8 |
| Pyridine | 50 | 2000 | 6 |
| 2-Fluorophenol | 0.5 | 20 | 6 |
| Phenol-d6 | 2 | 200 | 6 |
| Phenol | 2 | 200 | 5 |
| Aniline | 2 | 200 | 6 |
| 2-Chlorophenol | 0.5 | 200 | 7 |
| 2-Methylphenol | 5 | 200 | 6 |
| 3- and 4-Methylphenol | 2 | 1000 | 8 |
| Nitrobenzene-d5 | 5 | 1000 | 6 |
| 2-Nitrophenol | 5 | 200 | 5 |
| 2,4-Dimethylphenol | 2 | 200 | 6 |
| Benzoic acid | 100 | 2000 | 5 |
| 2,4-Dichlorophenol | 2 | 2000 | 9 |
| Naphthalene | 1 | 50 | 5 |
| 2,6-Dichlorophenol | 1 | 100 | 5 |
| 4-Chloroaniline | 2 | 200 | 6 |
| 4-Chloro-3-methylphenol | 5 | 2000 | 8 |
| 2-Methylnaphthalene | 1 | 2000 | 10 |
| 1-Methylnaphthalene | 1 | 2000 | 10 |
| 2,4,6-Trichlorophenol | 5 | 1000 | 7 |
| 2,4,5-Trichlorophenol | 10 | 2000 | 8 |
| 2-Fluorobiphenyl | 0.5 | 2000 | 11 |
| o-Nitroaniline | 1 | 100 | 6 |
| Acenaphthylene | 5 | 200 | 5 |
| 3-Nitroaniline | 2 | 100 | 6 |
| Acenaphthene | 5 | 2000 | 7 |
| 2,4-Dinitrophenol | 50 | 2000 | 6 |
| 4-Nitrophenol | 5 | 2000 | 8 |
| 2,3,4,6-Tetrachlorophenol | 10 | 2000 | 7 |
| Fluorene | 5 | 2000 | 9 |
| 4-Nitroaniline | 2 | 200 | 6 |
| 4,6-Dinitro-2-methylphenol | 5 | 100 | 5 |
| Diphenylamine | 5 | 200 | 5 |
| 2,4,6-Tribromophenol | 20 | 2000 | 7 |
| Pentachlorophenol | 10 | 1000 | 6 |
| Phenanthrene | 1 | 200 | 7 |
| Dinoseb | 10 | 200 | 5 |
| Anthracene | 5 | 200 | 6 |
| Fluoranthene | 10 | 200 | 5 |
| Benzidine | 50 | 2000 | 5 |
| Pyrene | 5 | 100 | 5 |
| p-Terphenyl-d14 | 1 | 200 | 7 |
| 3,3′-Dichlorobenzidine | 20 | 200 | 5 |
| Benz[a]anthracene | 20 | 500 | 5 |
| Chrysene | 10 | 1000 | 5 |
| Benzo[b]fluoranthene | 20 | 1000 | 5 |
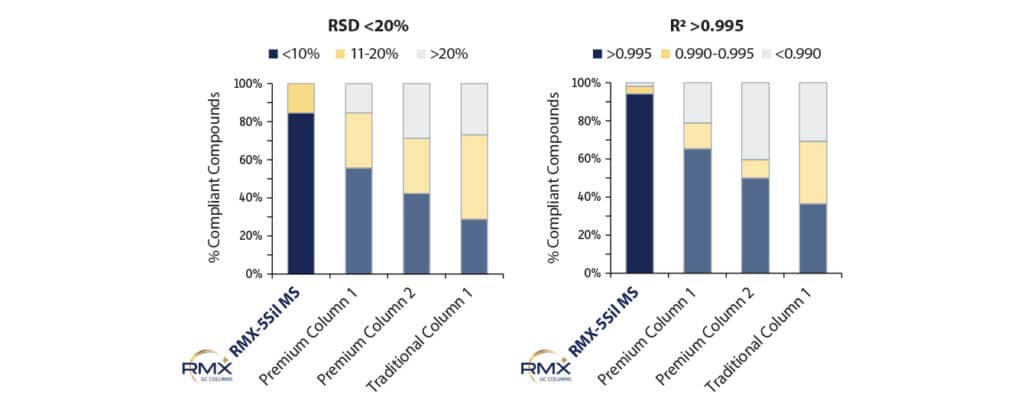
Dopo aver stabilito le curve di calibrazione lineare sulla colonna RMX-5Sil MS, sono state eseguite curve di calibrazione nuove su ciascuna colonna utilizzando lo stesso intervallo di calibrazione e le medesime impostazioni di integrazione. L’adattamento lineare di ciascuna curva di calibrazione è stato confrontato utilizzando il coefficiente R2 (non pesato) e la %RSD del fattore di risposta. In base a quanto emerso, la colonna RMX-5Sil MS ha prodotto risultati conformi al metodo per un numero maggiore di composti rispetto alle altre colonne (Figura 4). I valori superiori di R2 e %RSD ottenuti con la colonna RMX-5Sil MS dimostrano una migliore linearità complessiva delle curve di calibrazione, con un conseguente miglioramento della precisione e dell’accuratezza quantitative.
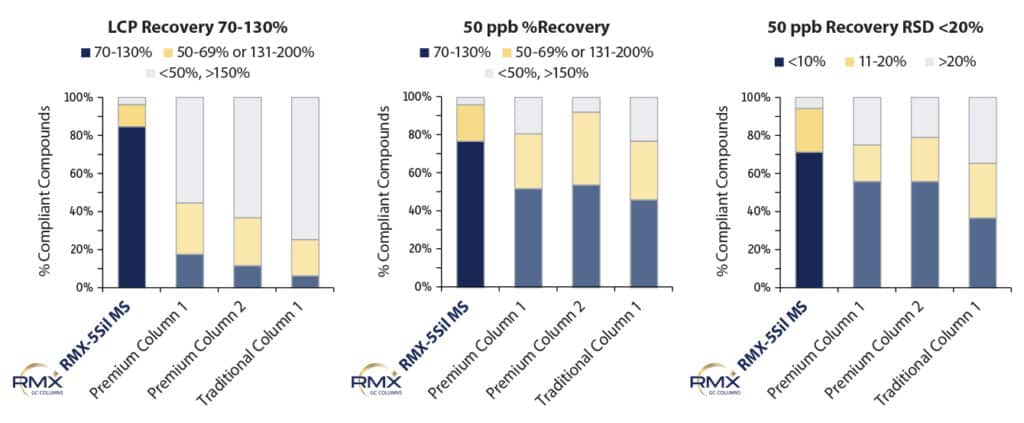
Recupero
Il recupero è stato determinato sia al punto di calibrazione più basso sia al livello intermedio di 50 ppb per valutare l’impatto della scelta della colonna. La ripetibilità dei risultati di recupero è stata valutata al livello intermedio di 50 ppb, poiché più rappresentativo delle prestazioni della colonna rispetto al punto di calibrazione più basso (LCP), dove la forma del picco è maggiormente influenzata dal rumore di fondo dello strumento. Come mostrato in Figura 5, i recuperi in corrispondenza del LCP sono risultati sostanzialmente migliori sulla colonna RMX-5Sil MS rispetto alle altre colonne testate, il che può essere attribuito a una deattivazione più efficace che migliora la risposta del picco e l’integrazione a livello di tracce. Sebbene i recuperi al livello intermedio di 50 ppb siano risultati abbastanza simili per tutte le colonne, i risultati di recupero sono stati molto più riproducibili sulla colonna RMX-5Sil MS. La ripetibilità dipende dal rapporto tra la forma del picco e l’algoritmo di integrazione, e anche piccole differenze nella forma del picco possono influenzare l’integrazione. I risultati altamente coerenti ottenuti con la colonna RMX-5Sil MS dimostrano che la deattivazione TriMax riduce al minimo l’attività superficiale che contribuisce alla variabilità tra le iniezioni.
Conclusioni
Sebbene le colonne di tipo 5 e 5sil presentino una selettività adeguata per l’analisi dei semivolatili e siano ampiamente utilizzate in tutto il mondo, le deattivazioni tradizionali non risultano completamente efficaci nel bloccare i siti attivi. Di conseguenza, i laboratori incontrano difficoltà nell’analisi dei composti più reattivi, in particolare a livello di tracce. La produttività può inoltre risentirne quando sono necessarie più colonne per differenti gruppi di analiti o quando iniziano a non essere soddisfatti i criteri di qualità. Sulla base dello studio comparativo presentato, la deattivazione TriMax di nuova concezione utilizzata nelle colonne RMX-5Sil MS ha prodotto una superficie della colonna significativamente più inerte, garantendo prestazioni superiori per diverse classi di composti. Di conseguenza, utilizzando le colonne RMX-5Sil MS, gli obiettivi di qualità dei dati sono stati soddisfatti per un numero maggiore di semivolatili rispetto ad altre
colonne analitiche. Queste prestazioni migliorate su un’ampia gamma di composti acidi, basici e neutri offrono ai laboratori maggiori opportunità di beneficiare di un ridotto consumo di solvente e del consolidamento dei metodi rispetto alle tradizionali colonne di tipo 5.
Bibliografia
- E. Pack, C. English, R. Dhandapani, and C. Myers, Increase lab efficiency with an expanded trace-level semivolatiles method, Featured application note, EVFA5253, Restek Corporation, 2025. https://discover.restek.com/articles/evfa5253/increase-lab-efficiency-with-an-expanded-trace-level-semivolatiles-method