Éléments clés
- La désactivation de nouvelle génération TriMax offre un circuit d’échantillon robuste et hautement inerte.
- Son inertie optimale offre une meilleure forme de pics pour une large gamme de composés semi-volatils, des plages d’étalonnage plus basses et une sensibilité jusqu’au picogramme.
- Ses performances maximales permettent d’analyser un plus grand nombre d’analytes et des volumes d’échantillons plus réduits.


Résumé
La présente étude examine l’impact de la désactivation révolutionnaire TriMax sur l’analyse des composés semi-volatils par GC-MS/MS. Les performances des quatre colonnes couramment utilisées ont été comparées en termes d’asymétrie des pics, de linéarité de l’étalonnage, du taux de récupération et de répétabilité pour une grande variété de compositions chimiques. Les résultats montrent que les colonnes RMX-5Sil MS dotées de la nouvelle désactivation TriMax, possèdent une surface considérablement plus inerte. Ces colonnes répondent aux critères de performances pour les composés semi-volatils acides, basiques et neutres, alors que les autres colonnes ne remplissent ces critères que pour certaines classes de composés. Les performances compétitives pour une large gamme de composés semi-volatils à faibles concentrations permettent aux laboratoires de simplifier leurs opérations au moyen de protocoles d’extraction simplifiés ou d’une consolidation des méthodes. La désactivation TriMax des colonnes RMX-5Sil MS permettent de surmonter les problèmes d’activité qui affectent les performances quantitatives des colonnes concurrentes.
Introduction
La présence des composés organiques semi-volatils (COSV) dans l’environnement est surveillée dans le monde entier en raison de leur prévalence et les risques qu’ils présentent pour la santé humaine. Les méthodes GC-MS et GC-MS/MS sont largement utilisées pour l’analyse des composés semi-volatils dans les échantillons environnementaux. Grâce à la sensibilité élevée de la détection en MS/MS, les laboratoires peuvent atteindre des limites de détection plus basses et économiser ainsi du solvant et du temps en réduisant les volumes d’extraction des échantillons. Les méthodes d’extraction à faible volume sont généralement plus simples et utilisent moins de solvant (par exemple, le dichlorométhane) que les méthodes d’extraction classiques. Toutefois, les extraits sont moins concentrés, ce qui favorise l’utilisation de la GC-MS/MS dans les laboratoires cherchant à réduire leur consommation de solvant tout en maintenant les performances de leurs méthodes.
Les composés semi-volatils couvrent une large gamme de compositions chimiques, dont certaines sont connues pour interagir avec les sites actifs (par exemple, les silanols) du circuit de l’échantillon. Il est donc difficile d’obtenir une détection fiable en cas de faibles concentrations. Pour surmonter les difficultés liées à ces interactions, les laboratoires peuvent utiliser différents types de colonnes GC en fonction des analytes cibles. Les colonnes de polarité intermédiaire “5” ou “5sil” sont couramment utilisées, mais lorsque les laboratoires cherchent à abaisser les limites de détection et à maximiser la sensibilité de leurs colonnes, les inconvénients des différents procédés de fabrication de ces colonnes de type 5 deviennent plus évidents. Les sites actifs résiduels à la surface des colonnes GC n’ont habituellement pas d’impact sur les composés neutres, mais les composés acides et basiques peuvent être sensibles même à une très faible présence de site actif en surface . Avec l’introduction des composés basiques (benzidine) et acides (pentachlorophénol) dans les essais de conformité des colonnes, ainsi que la nécessité d’étalonnages de plus en plus sensibles, les sites actifs à la surface des colonnes GC font l’objet d’un contrôle approfondi. Les colonnes GC qui présentent une désactivation efficace pour une large gamme de composés sont très demandées car elles produisent de meilleurs résultats pour les composés semi-volatils acides, basiques et neutres. Elles permettent donc aux laboratoires d’améliorer leur productivité et leur rentabilité grâce à une consommation réduite des solvants, des meilleures performances des instruments et davantage d’opportunités de consolidation des méthodes.
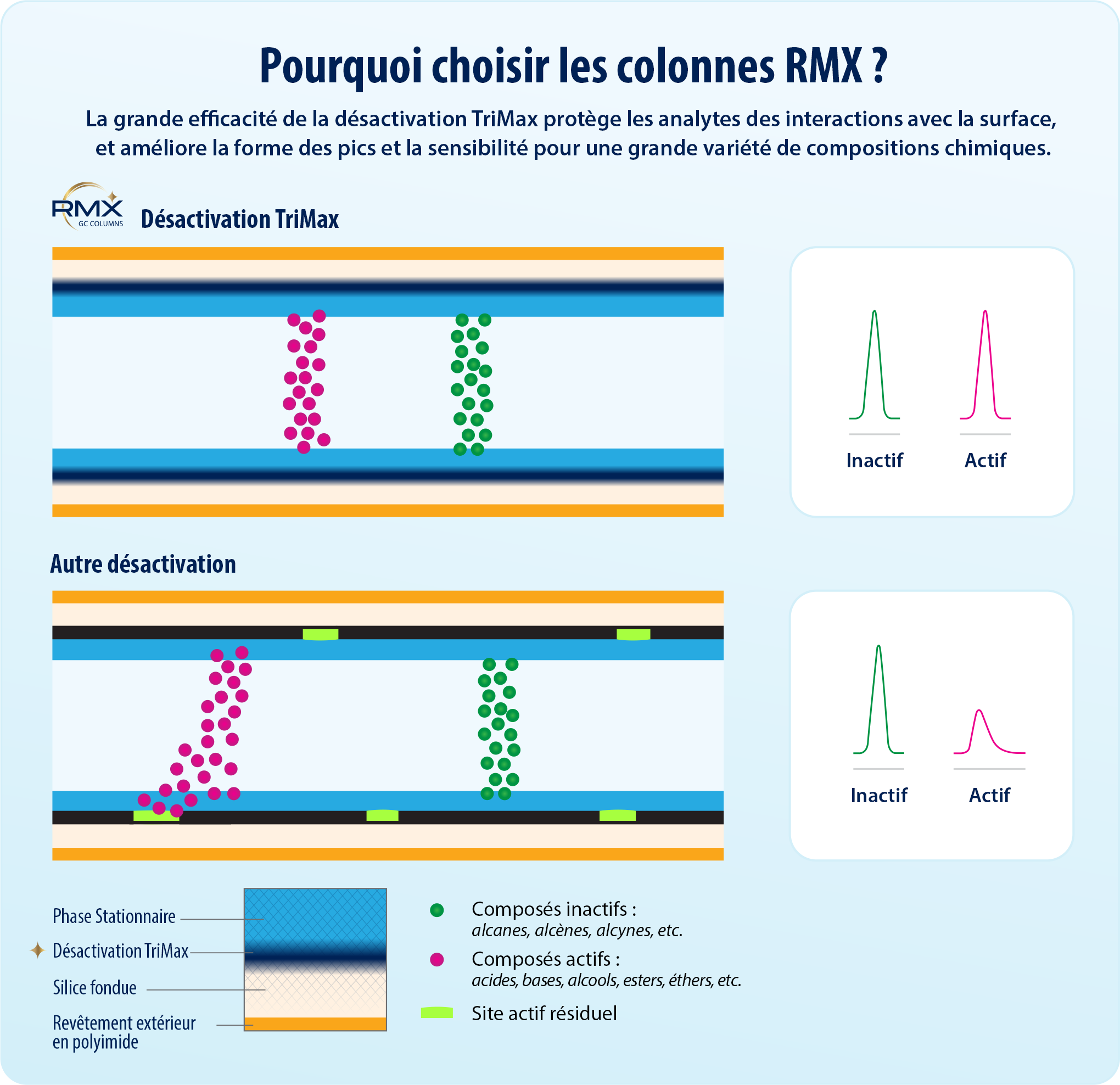
Dans cette étude, nous avons comparé les performances de plusieurs colonnes GC couramment utilisées pour l’analyse des composés semi-volatils avec les performances des colonnes RMX-5Sil MS. La surface des colonnes RMX-5Sil MS est soumise à une désactivation unique TriMax consistant à déposer un polymère résistant qui élimine les sites actifs et offre une inertie exceptionnelle dans le circuit de l’échantillon. La colonne RMX-5Sil MS s’appuie sur un polymère 5sil traditionnel (elle remplace donc directement les colonnes 5Sil). Sa surface hautement inerte améliore la forme des pics et les performances pour une grande variété de composés, ce qui permet d’abaisser les courbes d’étalonnage, tout en respectant les exigences de qualité des données.
Méthode expérimentale
Préparation des solutions-étalons et des échantillons
Des solutions-étalons de calibration contenant des composés semi-volatils acides, basiques et neutres ont été préparées dans le dichlorométhane, sur une gamme de 0,5 à 5000 ppb, afin de déterminer la plage d’étalonnage la plus basse pour chaque analyte. Des nouveaux étalons de calibration ont été préparés pour chaque colonne. Des étalons pour les tests de taux de récupération à concentration intermédiaire ont été également préparés à 50 ppb.
Conditions analytiques
Les échantillons ont été analysés sur quatre types de colonnes (RMX-5Sil MS, deux colonnes concurrentes « premium » et une colonne concurrente classique) de 30 m, DI 0.25 mm, 0.25 μm. L’analyse des composés semi-volatils est effectué à l’aide d’un GC Thermo TRACE 1310 couplé à un spectromètre de masse TSQ 8000. Les conditions utilisées ci-dessous sont simplifiées à des fins de normalisation et de comparaison directe des colonnes testées. Dans les travaux de routine, il est possible d’utiliser des paramètres différents pour l’injecteur, le four ou le détecteur, dans le but d’optimiser les résultats d’analyses. Les conditions optimisées sont présentées dans une autre étude menée à de faibles concentrations et portant sur une liste étendue de 150 composés semi-volatils couramment analysés [1].
Volume d’injection : 1 µL
Insert d’injection : Topaz Precision 4 mm avec laine (réf. 23267)
Injecteur : 250 °C; 5:1 split; 1.2 mL/min
Gaz vecteur : helium
Four : 40 °C (maintien 1 min) à 280 °C à 12,4 °C/min, puis 315 °C à 3,3 °C/min (maintien 1 min)
Détecteur : MS/MS ; mode SRM ; température de la ligne de transfert : 280 °C ; température de la source : 330 °C (voir les transitions SRM en Figure 1)
Évaluation de la qualité des données
La qualité des données a été évaluée selon l’asymétrie des pics, la linéarité, le taux de récupération et la répétabilité. Les performances générales pour chaque critère ont été classées selon le Tableau I. L’asymétrie a été évaluée pour chaque composé afin de mesurer l’inertie. La linéarité a été évaluée au moyen des valeurs R2 et %RSD (écart-type relatif). Le taux de récupération a été déterminé pour chaque analyte au point d’étalonnage le plus bas (LCP, “lowest calibration point”), ainsi qu’à 50 ppb, utilisé comme point intermédiaire. La répétabilité du taux de récupération a également été déterminée à 50 ppb.
Tableau I : Classification de la qualité des données
| Ideal | Acceptable | Poor | |
|---|---|---|---|
| Asymmetry | 0.9-1.2 | 0.5-0.9 or 1.2-2 | <0.5, >2 |
| Linearity (R2) | >0.995 | 0.990-0.995 | <0.990 |
| Linearity (%RSD) | <10% | 11-20% | >20% |
| Recovery (LCP) | 70-130% | 50-69% or 131-200% | <50%, >200% |
| Recovery (50 ppb) | 70-130% | 50-69% or 131-200% | <50%, >200% |
| Repeatability (%RSD at 50 ppb) | <10% | 11-20% | >20% |
Résultats et Discussion
Performances chromatographiques
Les silanols sont une source courante de sites actifs à la surface de la silice fondue des colonnes GC. Les fabricants de colonnes utilisent divers traitements de désactivation pour réduire leur impact. Toutefois, si la désactivation n’est pas entièrement efficace, l’interaction des analytes avec les silanols peut entraîner une séparation irrégulière ou retardée depuis la phase stationnaire, provoquant des traînées de pics et d’autres problèmes comme un décalage des temps de rétention et une perte de sensibilité. Les composés acides, en particulier les phénols, peuvent être retenus par les silanols par une liaison hydrogène, tandis que les composés basiques comme les benzidines peuvent se fixer à la surface par une interaction acide-base. L’une des difficultés de l’analyse des composés semi-volatils provient de la grande variété des classes de composés qui interagissent selon des mécanismes et des intensités différents . La désactivation des colonnes doit donc être efficace pour une large gamme de composés.
Afin de mieux maîtriser l’activité des silanols, Restek a développé la désactivation TriMax de nouvelle génération pour l’ensemble des colonnes RMX. Cette désactivation réduit le plus possible l’activité des silanols en surface grâce à une interface polymère/silice fondue robuste, empêchant ainsi les interactions entre les analytes et les silanols. La Figure 1 montre que la colonne RMX-5Sil MS offre d’excellentes performances chromatographiques et des pics fins et symétriques pour une grande variété de composés semi-volatils, notamment des composés complexes comme le 2,4-dinitrophénol (2,4-DNP) ; le pentachlorophénol et la benzidine.
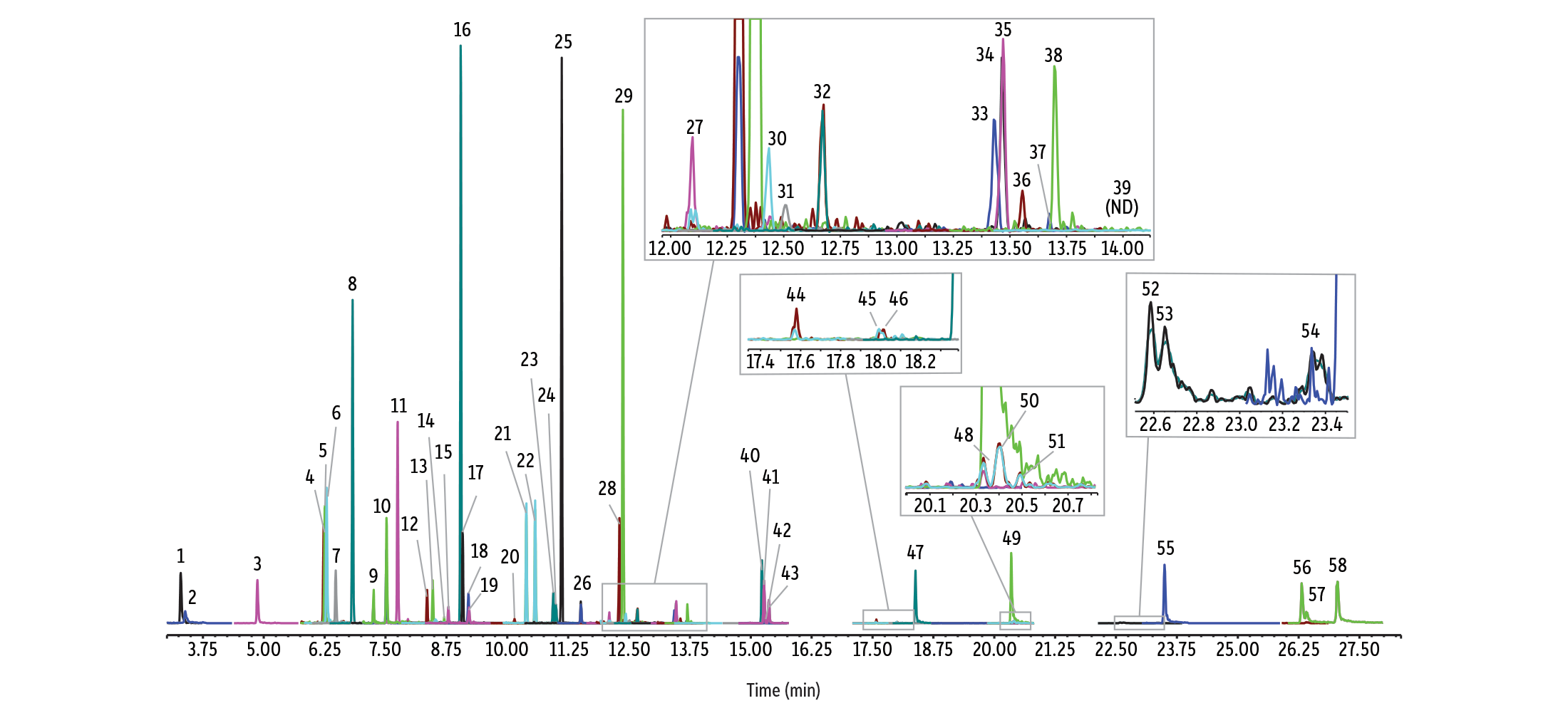
GC_EV1528
Peaks
| Peaks | tR (min) | Conc. (ng/mL) | Mass 1 | Product 1 | Collision energy 1 | Mass 2 | Product 2 | Collision energy 2 | |
|---|---|---|---|---|---|---|---|---|---|
| 1. | N-Nitrosodimethylamine | 3.55 | 50 | 74 | 44 | 6 | 74 | 42 | 16 |
| 2. | Pyridine | 3.59 | 50 | 79 | 51 | 26 | 52 | 26 | 18 |
| 3. | 2-Fluorophenol | 5.03 | 50 | 112 | 92 | 6 | 92 | 63 | 14 |
| 4. | Phenol-d6 | 6.37 | 50 | 99 | 71 | 8 | 99 | 69 | 18 |
| 5. | Phenol | 6.40 | 50 | 94 | 66 | 10 | 94 | 65 | 16 |
| 6. | Aniline | 6.45 | 50 | 93 | 66 | 10 | 93 | 65 | 20 |
| 7. | 2-Chlorophenol | 6.62 | 50 | 128 | 64 | 14 | 128 | 63 | 24 |
| 8. | 1,4-Dichlorobenzene-d4 | 6.96 | 100 | 150 | 115 | 14 | 150 | 78 | 26 |
| 9. | 2-Methylphenol | 7.38 | 50 | 108 | 80 | 8 | 108 | 77 | 24 |
| 10. | 3- and 4-Methylphenol | 7.66 | 50 | 70 | 43 | 6 | 107 | 77 | 14 |
| 11. | Nitrobenzene-d5 | 7.89 | 50 | 128 | 82 | 12 | 128 | 54 | 28 |
| 12. | 2-Nitrophenol | 8.54 | 50 | 139 | 81 | 12 | 139 | 109 | 8 |
| 13. | 2,4-Dimethylphenol | 8.61 | 50 | 122 | 107 | 12 | 122 | 77 | 20 |
| 14. | Benzoic acid | 8.72 | 50 | 122 | 105 | 8 | 122 | 77 | 20 |
| 15. | 2,4-Dichlorophenol | 8.95 | 50 | 162 | 63 | 24 | 162 | 98 | 12 |
| 16. | Naphthalene-d8 | 9.18 | 100 | 136 | 134 | 14 | 136 | 108 | 18 |
| 17. | Naphthalene | 9.23 | 50 | 128 | 102 | 16 | 129 | 103 | 14 |
| 18. | 4-Chloroaniline | 9.35 | 50 | 127 | 100 | 10 | 127 | 65 | 20 |
| 19. | 2,6-Dichlorophenol | 9.37 | 50 | 162 | 63 | 24 | 164 | 63 | 26 |
| 20. | 4-Chloro-3-methylphenol | 10.28 | 50 | 142 | 107 | 12 | 107 | 77 | 12 |
| 21. | 2-Methylnaphthalene | 10.53 | 50 | 141 | 115 | 16 | 141 | 89 | 30 |
| 22. | 1-Methylnaphthalene | 10.71 | 50 | 141 | 115 | 16 | 141 | 89 | 30 |
| 23. | 2,4,6-Trichlorophenol | 11.09 | 50 | 132 | 97 | 10 | 196 | 97 | 24 |
| 24. | 2,4,5-Trichlorophenol | 11.09 | 50 | 132 | 97 | 10 | 196 | 97 | 24 |
| 25. | 2-Fluorobiphenyl | 11.26 | 50 | 172 | 171 | 12 | 172 | 170 | 22 |
| 26. | o-Nitroaniline | 11.66 | 50 | 138 | 92 | 12 | 138 | 65 | 22 |
| 27. | Acenaphthylene | 12.24 | 50 | 152 | 102 | 26 | 152 | 76 | 36 |
| 28. | 3-Nitroaniline | 12.49 | 50 | 138 | 92 | 12 | 138 | 65 | 20 |
| 29. | Acenaphthene-d10 | 12.53 | 100 | 162 | 160 | 18 | 164 | 162 | 14 |
| 30. | Acenaphthene | 12.60 | 50 | 153 | 126 | 36 | 153 | 77 | 38 |
| 31. | 2,4-Dinitrophenol | 12.70 | 50 | 184 | 154 | 6 | 154 | 79 | 12 |
| 32. | 4-Nitrophenol | 12.90 | 50 | 139 | 109 | 6 | 139 | 81 | 14 |
| 33. | 2,3,4,6-Tetrachlorophenol | 13.21 | 50 | 232 | 168 | 12 | 234 | 131 | 24 |
| 34. | 4-Nitroaniline | 13.60 | 50 | 138 | 108 | 8 | 138 | 80 | 18 |
| 35. | Fluorene | 13.61 | 50 | 165 | 115 | 24 | 165 | 139 | 26 |
| 36. | 4,6-Dinitro-2-methylphenol | 13.71 | 50 | 198 | 168 | 6 | 198 | 121 | 10 |
| 37. | Diphenylamine | 13.88 | 50 | 169 | 66 | 22 | 170 | 66 | 22 |
| 38. | 2,4,6-Tribromophenol | 14.10 | 50 | 330 | 141 | 36 | 332 | 143 | 34 |
| 39. | Pentachlorophenol | 15.04 | 50 | 228 | 165 | 14 | 270 | 169 | 22 |
| 40. | Phenanthrene-d10 | 15.40 | 100 | 188 | 160 | 20 | 184 | 156 | 22 |
| 41. | Phenanthrene | 15.46 | 50 | 178 | 152 | 18 | 178 | 151 | 32 |
| 42. | Dinoseb | 15.49 | 50 | 163 | 116 | 14 | 240 | 211 | 8 |
| 43. | Anthracene | 15.54 | 50 | 178 | 152 | 18 | 177 | 151 | 18 |
| 44. | Fluoranthene | 17.78 | 50 | 202 | 176 | 26 | 202 | 152 | 30 |
| 45. | Benzidine | 18.05 | 50 | 184 | 156 | 18 | 184 | 166 | 16 |
| 46. | Pyrene | 18.20 | 50 | 200 | 174 | 22 | 200 | 149 | 34 |
| 47. | p-Terphenyl-d14 | 18.57 | 50 | 244 | 242 | 14 | 244 | 240 | 22 |
| 48. | 3,3′-Dichlorobenzidine | 20.53 | 50 | 252 | 154 | 26 | 252 | 181 | 22 |
| 49. | Chrysene-d12 | 20.55 | 100 | 240 | 238 | 14 | 240 | 236 | 30 |
| 50. | Benz[a]anthracene | 20.63 | 50 | 228 | 202 | 22 | 226 | 200 | 28 |
| 51. | Chrysene | 20.63 | 50 | 228 | 202 | 22 | 228 | 201 | 36 |
| 52. | Benzo[b]fluoranthene | 22.90 | 50 | 252 | 226 | 22 | 250 | 224 | 24 |
| 53. | Benzo[k]fluoranthene | 22.91 | 50 | 252 | 226 | 22 | 250 | 224 | 24 |
| 54. | Benzo[a]pyrene | 23.66 | 50 | 252 | 226 | 22 | 250 | 224 | 26 |
| 55. | Perylene-d12 | 23.81 | 100 | 264 | 262 | 20 | 264 | 260 | 34 |
| 56. | Indeno[1,2,3-cd]pyrene | 26.74 | 50 | 276 | 274 | 38 | 276 | 250 | 30 |
| 57. | Dibenz[a,h]anthracene | 26.80 | 50 | 139 | 126 | 8 | 139 | 113 | 14 |
| 58. | Benzo[ghi]perylene | 27.47 | 50 | 276 | 274 | 38 | 138 | 125 | 12 |
Conditions
| Column | RMX-5Sil MS, 30 m, 0.25 mm ID, 0.25 µm (cat.# 17323) |
|---|---|
| Standard/Sample | |
| 8270 Calibration mix #1 (cat.# 31618) | |
| 8270 Calibration mix #2 (cat.# 31619) | |
| 8270 Calibration mix #5 (cat.# 31995) | |
| Base neutral surrogate mix (4/89 SOW) (cat.# 31024) | |
| Acid surrogate mix (4/89 SOW) (cat.# 31025) | |
| Revised SV internal standard mix (cat.# 31886) | |
| Diluent: | Dichloromethane |
| Conc.: | 50 ppb (100 ppb internal standards) |
| Injection | |
| Inj. Vol.: | 1 µL split (split ratio 5:1) |
| Liner: | Topaz 4.0 mm ID Precision liner w/wool (cat.# 23267) |
| Inj. Temp.: | 250 °C |
| Split Vent Flow Rate: | 6 mL/min |
| Oven | |
| Oven Temp.: | 40 °C (hold 1 min) to 280 °C at 12.4 °C/min to 315 °C at 3.3 °C/min (hold 1 min) |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1.2 mL/min @ 40 °C |
| Detector | SRM/MRM |
|---|---|
| Acquisition Type: | SRM/MRM |
| Source Temp.: | 330 °C |
| Transfer Line Temp.: | 280 °C |
| Analyzer Type: | Triple Quadrupole |
| Ionization Mode: | EI |
| Collision Gas: | Ar |
| Tune Type: | PFTBA |
| Tune Emission Current: | 70 μA |
| Instrument | Thermo Scientific TSQ 8000 Triple Quadrupole GC-MS |
| Sample Preparation | Standards were combined and diluted to a concentration of 50 ppb with internal standards added at 100 ppb. |
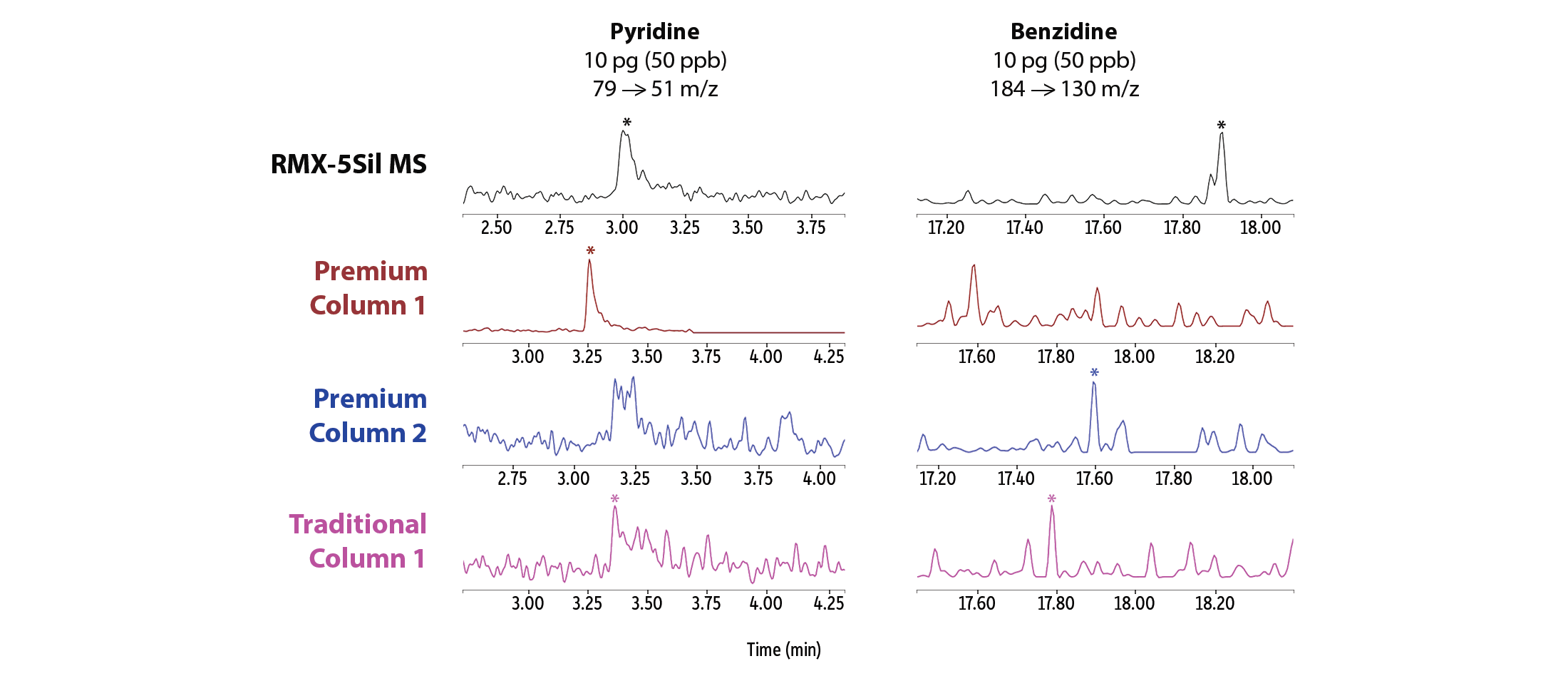
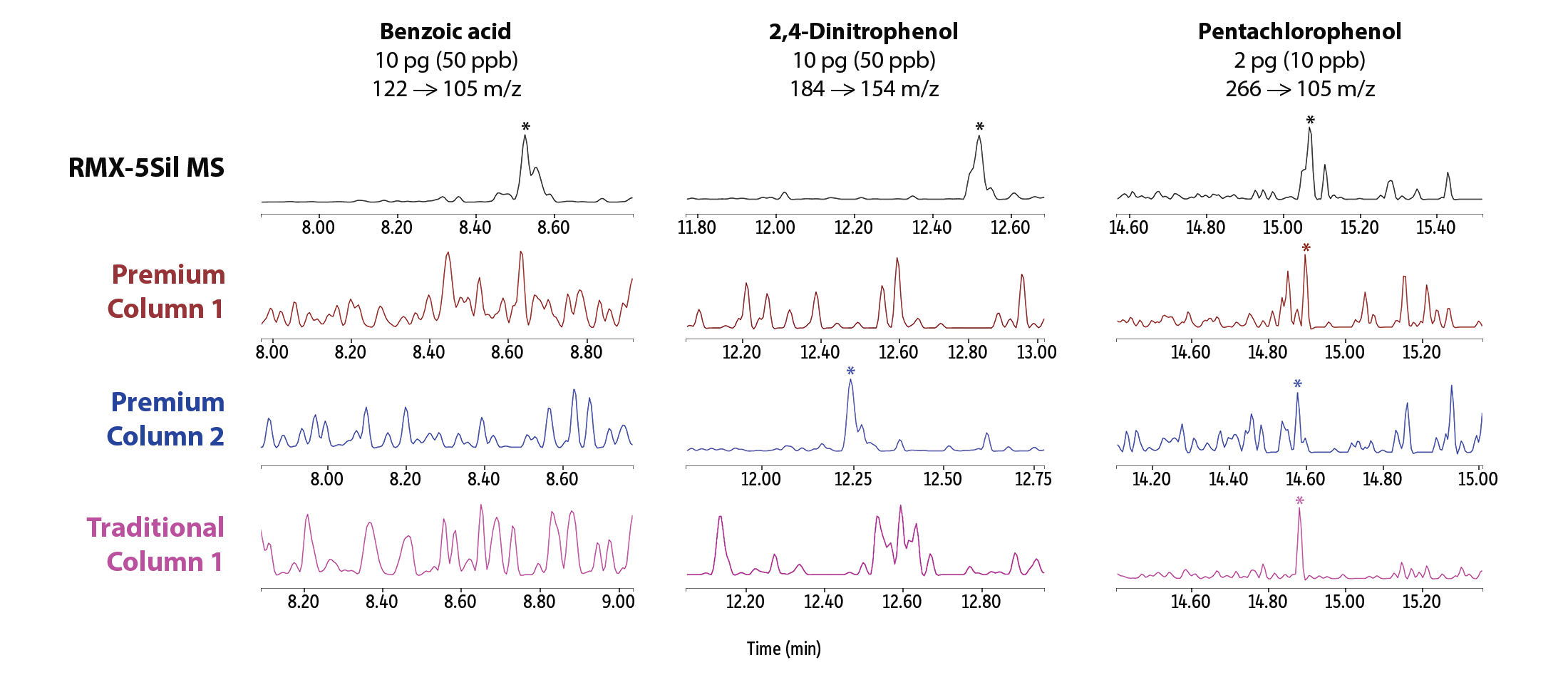
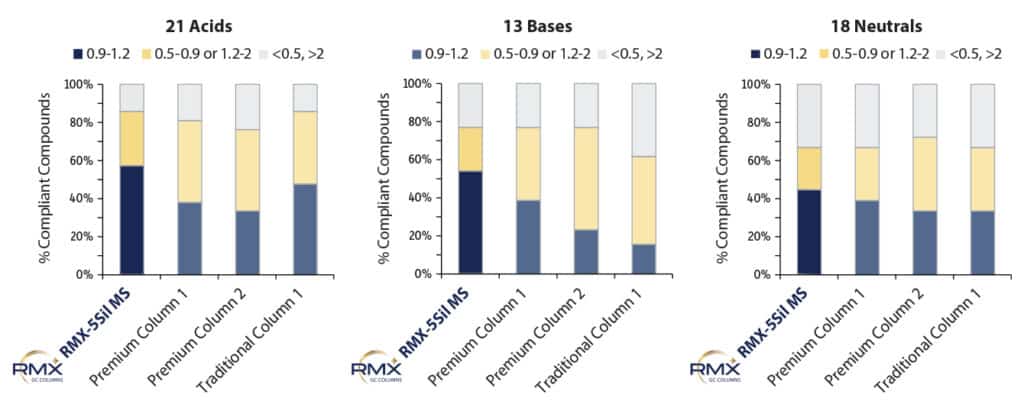
Afin de comparer l’inertie des colonnes RMX-5Sil MS à celle des colonnes couramment utilisées pour l’analyse des composés semi-volatils, nous avons évalué l’asymétrie des pics dans des conditions normalisées à 50 ppb. Le niveau de 50 ppb a été choisi pour évaluer l’asymétrie au point intermédiaire de la courbe d’étalonnage. L’évaluation au point intermédiaire compense les traînées de pics susceptibles de se confondre avec la ligne de base à faibles concentrations. La Figure 2 montre que pour les composés semi-volatils acides, basiques et neutres, la colonne RMX-5Sil MS a permis d’obtenir des résultats optimaux pour davantage de composés que les autres colonnes testées. La différence est particulièrement remarquable pour les composés acides et basiques, permettant une identification et quantification plus précises pour une large gamme de composés semi-volatils en une seule analyse. Cette spécificité offre aux laboratoires une opportunité de consolider leurs méthodes.
En plus d’une amélioration générale de l’asymétrie des pics, des signaux de meilleure qualité ont été observés à des concentrations très faibles pour une grande variété de composés semi-volatils réputés particulièrement complexes (Figure 3). Des meilleures formes de pics, qui permettent l’intégration facile avec le logiciel, ont été obtenus sur la colonne RMX-5Sil MS pour la pyridine, la benzidine, l’acide benzoïque, le 2,4-dinitrophénol et le pentachlorophénol. En revanche, les colonnes concurrentes ont montré des performances semblables pour certains composés, mais des performances nettement inférieures pour d’autres. Les différences visuelles entre les formes de pics montrent que l’inertie de la désactivation TriMax des colonnes RMX a une efficacité plus étendue que les désactivations classiques utilisées dans les autres colonnes.
Linéarité
La symétrie des pics améliore l’intégration et augmente le rapport signal/bruit qui en résulte, ce qui permet d’obtenir un étalonnage linéaire à des concentrations plus faibles. Les courbes d’étalonnage linéaires ont été établies pour chaque composé semi-volatil sur la colonne RMX-5Sil MS et elles variaient pour chaque analyte (Tableau II). Le nombre de points d’étalonnage variait de 5 à 11 et la concentration la plus faible allait de 0,5 à 100 ppb (0,1 à 20 pg « on-column »). Les paramètres d’intégration ont été maintenus pour chaque colonne car la linéarité de l’étalonnage est sensible à l’intégration des pics. Lorsque les pics se rapprochent de la ligne de base ou en cas de traînée de pics excessives, l’intégration manuelle devient nécessaire ce qui augmente le temps d’analyse par échantillon. D’autres modèles d’étalonnage peuvent être appliqués, par exemple des courbes d’étalonnage pondérées ou quadratiques, mais dans l’idéal l’étalonnage doit être linéaire. En utilisant un modèle linéaire pour chaque analyte, le rôle de l’intégration des pics devient plus important. Toutefois, il convient de noter que le point d’étalonnage linéaire le plus bas n’est pas nécessairement représentatif de la limite de détection la plus basse.
Tableau II : Plage d’étalonnage à partir des résultats et nombre de points d’étalonnage pour chaque composé semi-volatil
| Nom | Mini (ppb) | Maxi (ppb) | Nb de points |
|---|---|---|---|
| N-Nitrosodimethylamine | 2 | 1000 | 8 |
| Pyridine | 50 | 2000 | 6 |
| 2-Fluorophenol | 0.5 | 20 | 6 |
| Phenol-d6 | 2 | 200 | 6 |
| Phenol | 2 | 200 | 5 |
| Aniline | 2 | 200 | 6 |
| 2-Chlorophenol | 0.5 | 200 | 7 |
| 2-Methylphenol | 5 | 200 | 6 |
| 3- and 4-Methylphenol | 2 | 1000 | 8 |
| Nitrobenzene-d5 | 5 | 1000 | 6 |
| 2-Nitrophenol | 5 | 200 | 5 |
| 2,4-Dimethylphenol | 2 | 200 | 6 |
| Benzoic acid | 100 | 2000 | 5 |
| 2,4-Dichlorophenol | 2 | 2000 | 9 |
| Naphthalene | 1 | 50 | 5 |
| 2,6-Dichlorophenol | 1 | 100 | 5 |
| 4-Chloroaniline | 2 | 200 | 6 |
| 4-Chloro-3-methylphenol | 5 | 2000 | 8 |
| 2-Methylnaphthalene | 1 | 2000 | 10 |
| 1-Methylnaphthalene | 1 | 2000 | 10 |
| 2,4,6-Trichlorophenol | 5 | 1000 | 7 |
| 2,4,5-Trichlorophenol | 10 | 2000 | 8 |
| 2-Fluorobiphenyl | 0.5 | 2000 | 11 |
| o-Nitroaniline | 1 | 100 | 6 |
| Acenaphthylene | 5 | 200 | 5 |
| 3-Nitroaniline | 2 | 100 | 6 |
| Acenaphthene | 5 | 2000 | 7 |
| 2,4-Dinitrophenol | 50 | 2000 | 6 |
| 4-Nitrophenol | 5 | 2000 | 8 |
| 2,3,4,6-Tetrachlorophenol | 10 | 2000 | 7 |
| Fluorene | 5 | 2000 | 9 |
| 4-Nitroaniline | 2 | 200 | 6 |
| 4,6-Dinitro-2-methylphenol | 5 | 100 | 5 |
| Diphenylamine | 5 | 200 | 5 |
| 2,4,6-Tribromophenol | 20 | 2000 | 7 |
| Pentachlorophenol | 10 | 1000 | 6 |
| Phenanthrene | 1 | 200 | 7 |
| Dinoseb | 10 | 200 | 5 |
| Anthracene | 5 | 200 | 6 |
| Fluoranthene | 10 | 200 | 5 |
| Benzidine | 50 | 2000 | 5 |
| Pyrene | 5 | 100 | 5 |
| p-Terphenyl-d14 | 1 | 200 | 7 |
| 3,3′-Dichlorobenzidine | 20 | 200 | 5 |
| Benz[a]anthracene | 20 | 500 | 5 |
| Chrysene | 10 | 1000 | 5 |
| Benzo[b]fluoranthene | 20 | 1000 | 5 |
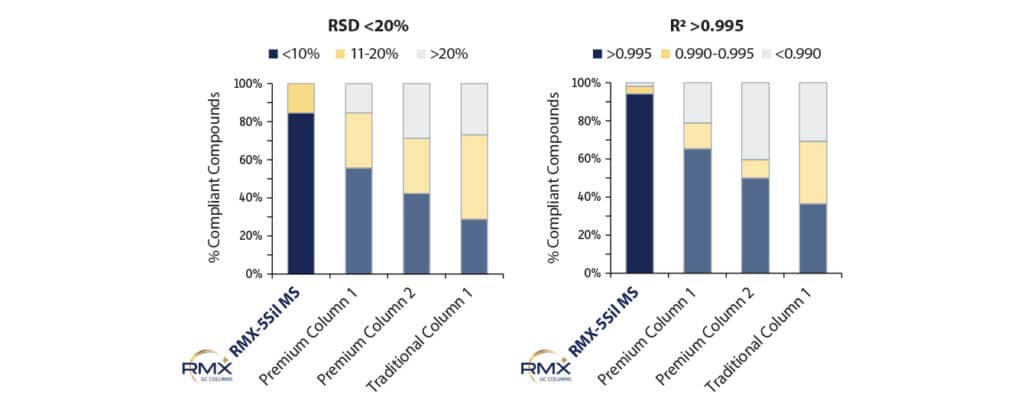
Après avoir établi les courbes d’étalonnage linéaires sur la colonne RMX-5Sil MS, de nouvelles courbes d’étalonnages ont été réalisées sur chaque colonne en utilisant une plage d’étalonnage et des paramètres d’intégration identiques. L’ajustement linéaire de chaque courbe d’étalonnage a été comparé en utilisant la valeur R2 (non pondérée) et l’écart-type relatif (%RSD). Les résultats ont montré que la colonne RMX-5Sil MS fournissait des résultats conformes à la méthode pour davantage de composés que les autres colonnes (Figure 4). Les valeurs R2 et %RSD (écart-type relatif) pour la colonne RMX-5Sil MS démontrent une meilleure linéarité globale de la courbe d’étalonnage, ce qui améliore la précision et l’exactitude quantitatives.
Taux de récupération
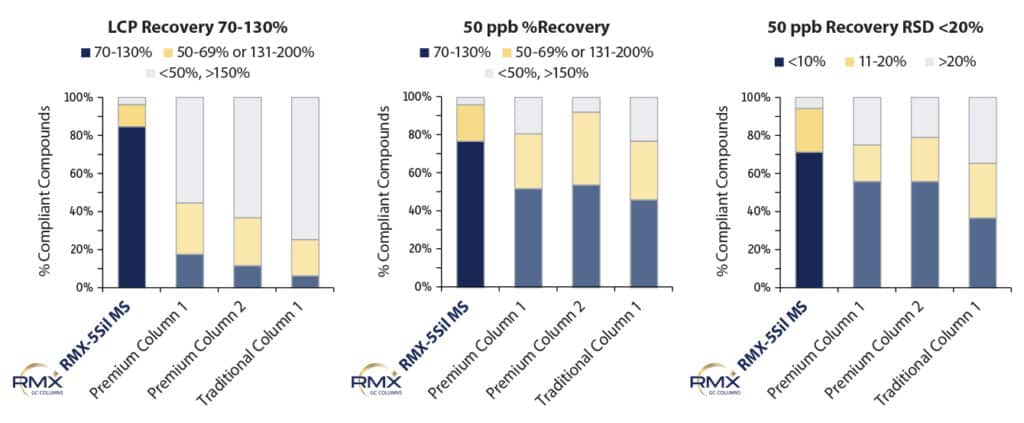
Le taux de récupération a été déterminé au point d’étalonnage le plus bas et au point intermédiaire (50 ppb) afin d’évaluer l’impact du choix de la colonne. La répétabilité des taux de récupération a été évaluée au point intermédiaire de 50 ppb car celui-ci est plus représentatif des performances des colonnes que le point d’étalonnage le plus bas, où la forme des pics risque d’être influencée par les bruits de ligne de base générés par l’instrument. La Figure 5 montre que les taux de récupérations au point d’étalonnage le plus bas étaient bien meilleures sur la colonne RMX-5Sil MS que sur les autres colonnes testées. Ce résultat peut être attribué à une désactivation plus efficace qui améliore la réponse et l’intégration des pics pour l’analyse de traces. Les taux de récupérations étaient plutôt similaires pour toutes les colonnes au point intermédiaire de 50 ppb, mais les résultats de récupération étaient bien plus réguliers sur la colonne RMX-5Sil MS. La répétabilité dépend du rapport entre la forme des pics et l’algorithme d’intégration, des légères différences dans la forme des pics peuvent affecter l’intégration. Les résultats très réguliers obtenus sur la colonne RMX-5Sil MS indiquent que sa désactivation TriMax réduit le plus possible l’activité de la surface qui contribue aux variations entre les injections.
Conclusion
Les colonnes de type 5 et 5sil offrent une sélectivité appropriée pour l’analyse des composés semi-volatils et elles sont très utilisées dans le monde entier, mais les désactivations classiques ne sont pas entièrement efficaces pour bloquer les sites actifs. Par conséquent, les laboratoires rencontrent des difficultés pour analyser les composés actifs, surtout à l’état de traces. La productivité peut encore être affectée si plusieurs colonnes sont nécessaires pour différents groupes d’analytes ou lorsque les critères de qualité ne sont plus suffisants[CC1.1][CC2.1]. D’après cette étude comparative, la désactivation révolutionnaire TriMax utilisée dans les colonnes RMX-5Sil MS a permis d’obtenir une surface bien plus inerte, offrant des performances supérieures pour l’ensemble des classes de composés. Ainsi, l’utilisation des colonnes RMX-5Sil MS a permis de respecter[CC3.1] les objectifs de qualité des données pour un plus grand nombre de composés semi-volatils par rapport à d’autres colonnes analytiques. Cette performance améliorée pour une large gamme de composés acides, basiques et neutres offre aux laboratoires de nouvelles opportunités pour bénéficier d’une réduction de consommation de solvant et d’une consolidation de méthode par rapport aux colonnes de type 5 classiques.
Références
- E. Pack, C. English, R. Dhandapani, and C. Myers, Increase lab efficiency with an expanded trace-level semivolatiles method, Featured application note, EVFA5253, Restek Corporation, 2025. https://discover.restek.com/articles/evfa5253/increase-lab-efficiency-with-an-expanded-trace-level-semivolatiles-method