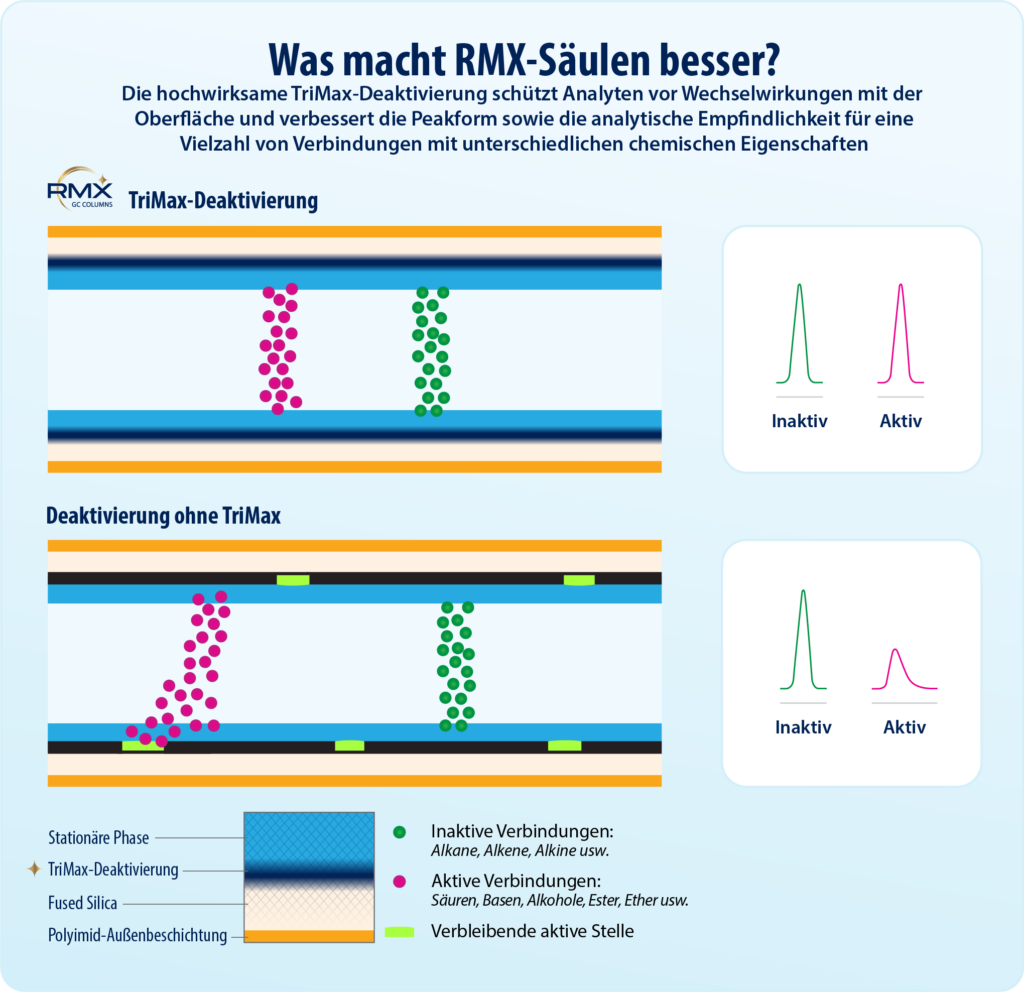
Key Highlights
- Die neue innovative TriMax-Deaktivierung sorgt für einen außergewöhnlich inerten Probenflussweg und reduziert Wechselwirkungen mit der stationären Phase auf ein Minimum.
- Die hohe Inertheit führt zu scharfen, symmetrischen Peaks und ermöglicht instrumentelle Nachweisgrenzen (IDL) von 1 pg oder weniger für eine Vielzahl anspruchsvoller Analyten.
- Die Kalibrierung erfüllte die Datenqualitätsziele für alle halbflüchtigen Verbindungen problemlos: Der relative Standardfehler (RSE) lag durchgängig bei ≤ 20 %, mit niedrigsten Kalibrierpunkten von 1–10 ppb; lediglich Benzoesäure erforderte einen höheren Einstiegspunkt von 50 ppb.


Zusammenfassung
Diese Application Note untersucht die Leistungsfähigkeit der RMX-5Sil MS-Säule für die GC-MS/MS-Analyse halbflüchtiger organischer Verbindungen im Spurenbereich. Für nahezu alle untersuchten Verbindungen wurden instrumentelle Nachweisgrenzen von 1 pg oder weniger erreicht. Lediglich für Benzoesäure (14,70 pg) und 2,4-Dinitrophenol (11,53 pg) lagen die Nachweisgrenzen höher.
Die Kalibrierungen zeigten über alle Verbindungen hinweg eine gute Reproduzierbarkeit. Der relative Standardfehler (%RSE) der Kalibrierkurven lag durchgängig bei ≤ 20 %. Die linearen Bereiche erstreckten sich für die meisten Verbindungen über 1–1000 ppb bzw. 10–1000 ppb; Benzoesäure wurde im Bereich von 50–1000 ppb kalibriert.
Einführung
Umweltprüflabore analysieren halbflüchtige organische Verbindungen (SVOCs) routinemäßig mit GC-MS oder GC-MS/MS, häufig nach etablierten Verfahren wie der EPA-Methode 8270E. Zunehmend kommen dabei GC-MS/MS-Methoden zum Einsatz. Der Grund dafür ist die höhere Selektivität des Detektors, die empfindlichere Messungen ermöglicht.
Diese gesteigerte Empfindlichkeit ist insbesondere bei Probenvorbereitungstechniken wie der Mikroextraktion nach der EPA-Methode 3511 von Vorteil. Im Vergleich zu klassischen Verfahren, bei denen bis zu einem Liter Probe verarbeitet wird, lassen sich so sowohl Zeit als auch Lösemittel einsparen.
Damit das volle Potenzial der MS/MS-Empfindlichkeit ausgeschöpft werden kann, ist jedoch eine hochinerte analytische Säule entscheidend. Nur so lässt sich ein optimales Signal-Rausch-Verhältnis erzielen. Voraussetzung dafür ist eine breit wirksame Säulendeaktivierung, die für Verbindungen mit sehr unterschiedlichen chemischen Eigenschaften gleichermaßen funktioniert. Diese Analyten interagieren über verschiedene Mechanismen mit aktiven Stellen auf der Säulenoberfläche und stellen entsprechend hohe Anforderungen an die Säuleninertheit.
Die vorliegende Studie bewertet unabhängig die analytische Leistungsfähigkeit einer RMX-5Sil-MS-Säule für eine Vielzahl halbflüchtiger Verbindungen im Spurenbereich, darunter auch analytisch anspruchsvolle Substanzen. Untersucht wurden sowohl die chromatografische Performance als auch die erzielbaren Kalibrierbereiche, um die Eignung der Säule für den Nachweis im Pikogrammbereich zu beurteilen.
Experimenteller Teil
Herstellung der Standards
Mehrkomponenten-Kalibrierstandards wurden in Methylenchlorid über einen Bereich von 1–1000 ppb (11 Messpunkte) aus handelsüblichen Referenzstandards hergestellt.
Gerät
Die Proben wurden auf einer RMX-5Sil MS-Säule (30 m, 0.25 mm ID, 0.25 μm (Art.-Nr. 17323)) analysiert.
Die GC-MS/MS-Analysen halbflüchtiger Verbindungen wurden mit einem Shimadzu Nexis GC-2030 in Kombination mit einem GCMS-TQ8050 NX Triple-Quadrupol-Massenspektrometer (EI-Quelle, UFsweeper-Kollisionszelle) durchgeführt; die Versuchsbedingungen sind unten angegeben.
Tabelle I: GC-MS/MS Methodenbedingungen für die Analyse von halbflüchtigen Verbindungen im Spurenbereich
| Gaschromatograph | Shimadzu Nexis GC-2030 |
| Säule | RMX-5Sil MS, 30 m x 0.25 mm ID x 0.25 µm (Art.-Nr. 17323) |
| Flow-Modus | Konstante lineare Geschwindigkeit (39.5 cm/s) |
| Injektormodus | Split (5:1) |
| Injektor Liner | 3.5 mm Topaz Single Taper Inlet Liner m. Glaswolle (Art.-Nr. 23336) |
| Injektionsvolumen | 1 µL |
| Injektortemperatur | 275 °C |
| Ofenprogramm | 40 °C (1.5 min) auf 280 °C mit 20 °C/min auf 320 °C mit 5 °C/min (1 min) |
| MS-System | Ultraschnelles Shimadzu GCMS-TQ8050 NX-Massenspektrometer mit EI-Quelle und hocheffizienter UFsweeper-Kollisionszelle |
| Ionisation | Elektronenstoß |
| Ionisationsenergie | 70 eV |
| Emissionsstrom | 60 mA |
| Erfassungsmodus | MRM |
| Kollisionsgas | Argon |
| Quellentemperatur | 230 °C |
| Temperatur der GC-Schnittstelle | 300 °C |
Ergebnisse und Diskussion
Chromatografische Performance
Insgesamt zeigte die RMX-5Sil MS-Säule für 86 halbflüchtige Verbindungen bei 50 ppb über den gesamten chromatografischen Bereich hinweg sehr gute Peakformen und Trennleistungen. Die letzte Verbindung eluierte dabei nach knapp 21 Minuten (Abbildung 1). Zur Bewertung der Säuleninertheit wurde das Peaktailing am unteren und oberen Ende des linearen Kalibrierbereichs untersucht. Der Fokus lag dabei auf sauren und basischen Verbindungen, die aufgrund ihrer Reaktivität als besonders kritisch gelten. Wie Abbildung 2 zeigt, reduziert die inerte Säulenoberfläche Oberflächenwechselwirkungen insbesondere bei niedrigen Konzentrationen deutlich. Gleichzeitig werden symmetrische Peaks erzielt, die eine einfache und zuverlässige Integration ermöglichen – auch für analytisch schwierige Verbindungen im Spurenbereich. Darüber hinaus beeinflusst die inerte Oberfläche die Polymerselektivität nicht negativ. Dies zeigt sich in der guten Trennung eng eluierender polyzyklischer aromatischer Kohlenwasserstoffe, wie Benzo[b]fluoranthen und Benzo[k]fluoranthen, selbst bei einer Konzentration von 1 ppb.
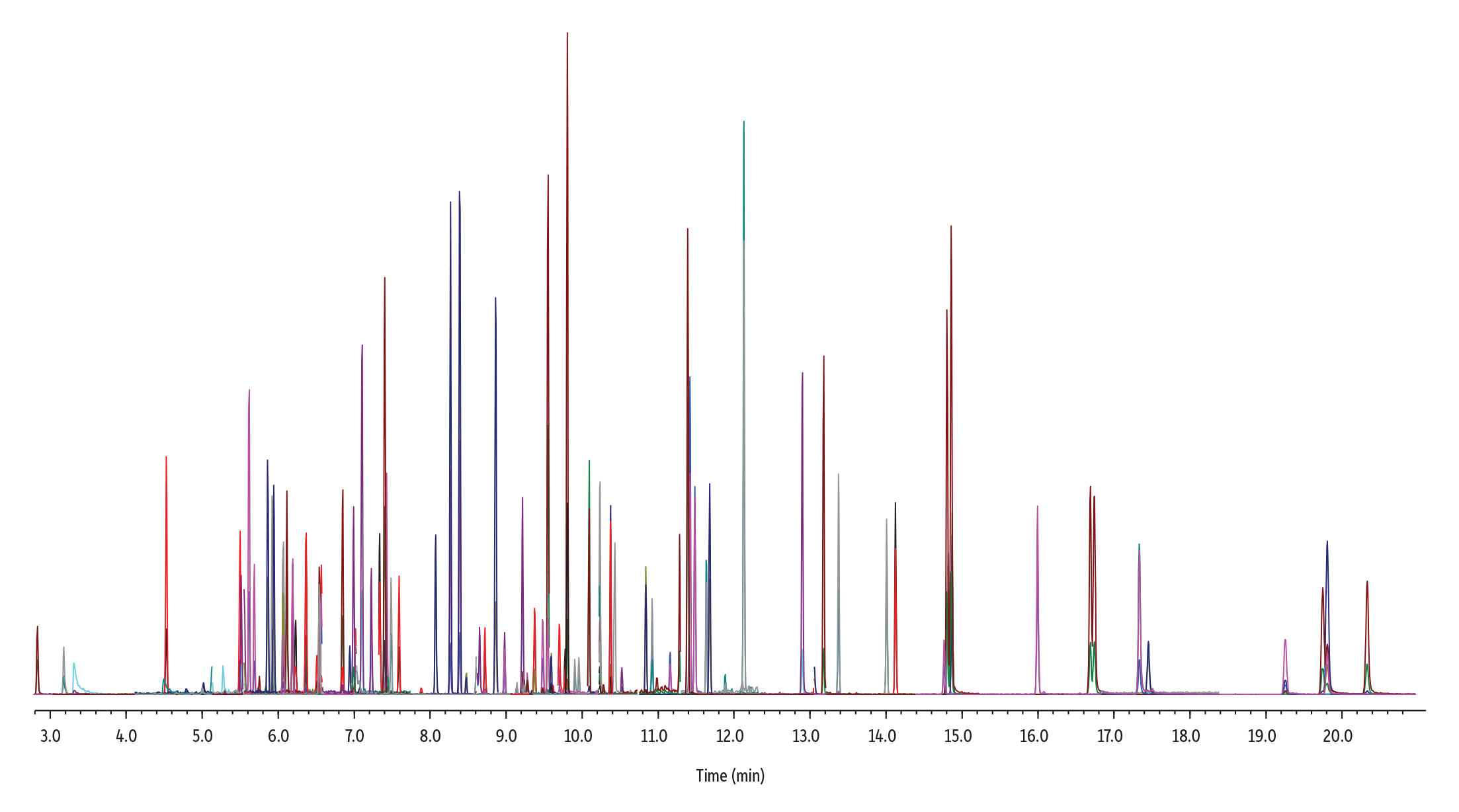
GC_EV1534
Peaks
| Peaks | tR (min) | Transition 1 | Collision energy 1 | Transition 2 | Collision energy 2 | |
|---|---|---|---|---|---|---|
| 1. | N-Nitrosodimethylamine | 3.173 | 74.00>44.10 | 6 | 74.00>42.10 | 18 |
| 2. | Pyridine | 3.276 | 79.10>50.10 | 21 | 79.10>52.10 | 15 |
| 3. | 2-Fluorophenol | 4.532 | 112.00>64.10 | 18 | 112.00>92.10 | 9 |
| 4. | Phenol | 5.514 | 94.00>66.00 | 9 | 66.00>40.00 | 12 |
| 5. | Phenol-d5 Surr | 5.5 | 99.00>71.10 | 12 | 99.00>69.10 | 27 |
| 6. | Aniline | 5.554 | 93.00>66.10 | 18 | 93.00>51.10 | 30 |
| 7. | Bis(2-chloroethyl) ether | 5.619 | 93.00>63.10 | 9 | 95.00>65.00 | 6 |
| 8. | 2-Chlorophenol | 5.688 | 128.00>64.00 | 18 | 128.00>91.90 | 15 |
| 9. | 1,3-Dichlorobenzene | 5.863 | 146.00>111.10 | 21 | 146.00>75.20 | 30 |
| 10. | 1,4-Dichlorobenzene | 5.944 | 146.00>111.10 | 21 | 146.00>75.20 | 30 |
| 11. | Benzyl alcohol | 6.069 | 79.00>77.10 | 12 | 107.00>79.10 | 9 |
| 12. | 1,2-Dichlorobenzene | 6.116 | 146.00>111.10 | 21 | 146.00>75.20 | 30 |
| 13. | 2-Methylphenol | 6.194 | 108.00>77.00 | 27 | 108.00>79.00 | 18 |
| 14. | 2,2′-oxybis(1-chloropropane) | 6.229 | 121.05>77.00 | 9 | 121.05>45.00 | 6 |
| 15. | 3 and 4-Methylphenol | 6.369 | 107.10>77.10 | 15 | 107.10>79.10 | 6 |
| 16. | N-Nitrosodi-N-propylamine | 6.374 | 130.10>113.10 | 4 | 130.10>88.10 | 4 |
| 17. | Hexachloroethane | 6.511 | 117.00>81.90 | 30 | 119.00>83.80 | 33 |
| 18. | Nitrobenzene | 6.563 | 77.05>51.00 | 21 | 123.05>77.00 | 15 |
| 19. | Nitrobenzene-d5 | 6.541 | 82.00>54.10 | 18 | 128.00>82.10 | 18 |
| 20. | Isophorone | 6.846 | 82.00>54.00 | 9 | 138.00>82.00 | 18 |
| 21. | 2-Nitrophenol | 6.941 | 139.00>109.10 | 9 | 139.00>81.00 | 12 |
| 22. | 2,4-Dimethylphenol | 6.99 | 107.00>77.10 | 18 | 122.00>107.10 | 18 |
| 23. | Benzoic Acid | 7.019 | 122.10>105.10 | 9 | 105.10>77.10 | 15 |
| 24. | Bis(2-chloroethoxy)methane | 7.102 | 93.00>63.10 | 9 | 95.00>65.00 | 6 |
| 25. | 2,4-Dichlorophenol | 7.223 | 162.00>63.10 | 33 | 164.00>63.10 | 30 |
| 26. | 1,2,4-Trichlorobenzene | 7.333 | 180.00>109.00 | 30 | 180.00>145.10 | 18 |
| 27. | Naphthalene | 7.424 | 128.10>102.10 | 20 | 128.10>78.00 | 20 |
| 28. | 2,6-Dichlorophenol | 7.223 | 136.00>108.10 | 27 | 136.00>134.10 | 27 |
| 29. | 4-Chloroaniline | 7.484 | 127.00>65.10 | 27 | 127.00>92.10 | 18 |
| 30. | Hexachlorobutadiene | 7.59 | 225.00>189.80 | 21 | 225.00>155.00 | 30 |
| 31. | 4-Chloro-3-methylphenol | 8.072 | 107.00>77.10 | 18 | 142.00>107.00 | 18 |
| 32. | 2-Methylnaphthalene | 8.268 | 142.10>115.10 | 28 | 115.10>89.00 | 16 |
| 33. | 1-Methylnaphthalene | 8.388 | 142.10>115.10 | 28 | 115.10>89.00 | 16 |
| 34. | Hexachlorocyclopentadiene | 8.474 | 237.00>141.00 | 27 | 237.00>143.00 | 27 |
| 35. | 2,4,6-Trichlorophenol | 8.613 | 196.00>97.00 | 33 | 198.00>97.00 | 30 |
| 36. | 2,4,5-Trichlorophenol | 8.651 | 196.00>97.00 | 33 | 198.00>97.00 | 30 |
| 37. | 2-Fluorobiphenyl | 8.721 | 172.00>151.20 | 27 | 172.00>146.10 | 27 |
| 38. | 2-Chloronaphthalene | 8.862 | 162.00>127.10 | 18 | 162.00>77.10 | 33 |
| 39. | 2-Nitroaniline | 8.979 | 138.00>92.00 | 15 | 138.00>65.10 | 33 |
| 40. | 1,4-Dinitrobenzene | 9.143 | 168.00>75.10 | 30 | 168.00>92.00 | 15 |
| 41. | Dimethylphthalate | 9.216 | 163.00>77.20 | 15 | 163.00>133.10 | 15 |
| 42. | 1,3-Dinitrobenzene | 9.14 | 168.00>75.00 | 30 | 168.00>122.00 | 12 |
| 43. | 2,6-Dinitrotoluene | 9.281 | 165.00>90.00 | 15 | 165.00>63.10 | 33 |
| 44. | Acenapthylene | 9.374 | 152.10>150.10 | 28 | 152.10>126.10 | 28 |
| 45. | 3-Nitroaniline | 9.484 | 92.05>65.00 | 12 | 138.05>65.00 | 27 |
| 46. | Acenaphthene | 9.592 | 152.10>150.10 | 28 | 152.10>126.10 | 28 |
| 47. | 2,4-Dinitrophenol | 9.617 | 184.05>107.00 | 12 | 154.05>107.00 | 6 |
| 48. | 4-Nitrophenol | 9.689 | 109.05>81.00 | 12 | 109.05>53.10 | 18 |
| 49. | 2,4-Dinitrotoluene | 9.778 | 89.05>63.10 | 18 | 165.05>119.00 | 6 |
| 50. | Dibenzofuran | 9.805 | 168.00>139.10 | 24 | 139.00>89.10 | 21 |
| 51. | 2,3,5,6-Tetrachlorophenol | 9.904 | 230.00>130.90 | 36 | 232.00>132.90 | 36 |
| 52. | 2,3,4,6-Tetrachlorophenol | 9.958 | 230.00>130.90 | 36 | 232.00>132.90 | 36 |
| 53. | Diethylphthalate | 10.093 | 149.00>65.00 | 30 | 177.00>149.10 | 12 |
| 54. | 4-Chlorophenyl phenyl ether | 10.234 | 141.00>115.20 | 21 | 204.00>141.20 | 21 |
| 55. | Fluorene | 10.23 | 165.10>163.10 | 28 | 165.10>115.10 | 28 |
| 56. | 4-Nitroaniline | 10.234 | 138.00>108.10 | 12 | 108.00>80.00 | 12 |
| 57. | 4,6-Dinitro-2-methylphenol | 10.283 | 198.05>121.00 | 12 | 198.05>53.00 | 27 |
| 58. | N-Nitrosodiphenylamine (Diphenylamine) | 10.376 | 169.00>167.20 | 27 | 168.00>139.00 | 39 |
| 59. | Diphenylhydrazine | 10.429 | 77.00>51.20 | 15 | 77.00>74.10 | 33 |
| 60. | 2,4,6-Tribromophenol | 10.524 | 329.80>141.00 | 36 | 331.80>142.90 | 36 |
| 61. | 4-Bromophenyl phenyl ether | 10.839 | 250.00>141.10 | 21 | 248.00>141.10 | 18 |
| 62. | Hexachlorobenzene | 10.922 | 283.80>248.80 | 24 | 283.80>213.80 | 28 |
| 63. | Pentachlorophenol | 11.159 | 265.90>164.90 | 26 | 265.90>166.90 | 26 |
| 64. | Phenanthrene | 11.421 | 178.10>176.10 | 28 | 178.10>152.10 | 20 |
| 65. | Anthracene | 11.484 | 178.10>176.10 | 28 | 178.10>152.10 | 20 |
| 66. | Carbazole | 11.68 | 167.00>139.20 | 27 | 166.00>140.00 | 18 |
| 67. | Di-n-butylphthalate | 12.131 | 149.00>93.10 | 18 | 149.00>65.10 | 24 |
| 68. | Fluoranthene | 12.9 | 202.10>200.10 | 30 | 200.10>198.10 | 30 |
| 69. | Benzidine | 13.062 | 184.00>156.10 | 24 | 184.00>167.10 | 24 |
| 70. | Pyrene | 13.18 | 202.10>200.10 | 30 | 200.10>198.10 | 30 |
| 71. | o-Terphenyl-D14 | 13.377 | 244.00>240.10 | 30 | 244.00>226.20 | 18 |
| 72. | Butylbenzylphthalate | 14.012 | 149.00>65.10 | 24 | 149.00>93.10 | 18 |
| 73. | Bis(2-ethylhexyl)adipate | 14.129 | 129.00>55.10 | 21 | 129.00>101.10 | 9 |
| 74. | 3’3-Dichlorobenzidine | 14.769 | 212.00>180.10 | 24 | 212.00>196.20 | 21 |
| 75. | Benz[a]anthracene | 14.805 | 228.10>226.10 | 32 | 226.10>224.10 | 32 |
| 76. | Bis(2-ethylhexyl)phthalate | 14.875 | 149.00>65.10 | 24 | 167.00>149.10 | 15 |
| 77. | Chrysene | 14.861 | 228.10>226.10 | 32 | 226.10>224.10 | 32 |
| 78. | Di-n-octylphthalate | 16 | 149.00>65.10 | 24 | 149.00>93.20 | 18 |
| 79. | Benzo[b]fluoranthene | 16.691 | 252.10>250.10 | 36 | 250.10>248.10 | 36 |
| 80. | Benzo[k]fluoranthene | 16.746 | 252.10>250.10 | 36 | 250.10>248.10 | 36 |
| 81. | Benzo[a]pyrene | 17.338 | 252.10>250.10 | 36 | 250.10>248.10 | 36 |
| 82. | Dibenz[a,j]acridine | 19.26 | 279.00>277.10 | 33 | 279.00>250.00 | 45 |
| 83. | Indeno[1,2,3-cd]pyrene | 19.754 | 276.10>274.10 | 36 | 274.10>272.10 | 36 |
| 84. | Dibenz[a,h]anthracene | 19.813 | 278.10>276.10 | 36 | 278.10>274.10 | 60 |
| 85. | Benzo[g,h,i]perylene | 20.339 | 276.10>274.10 | 36 | 274.10>272.10 | 36 |
Conditions
| Column | RMX-5Sil MS, 30 m, 0.25 mm ID, 0.25 µm (cat.# 17323) |
|---|---|
| Injection | |
| Inj. Vol.: | 1 µL split (split ratio 5:1) |
| Liner: | Topaz 3.5 mm ID single taper inlet liner w/wool (cat.# 23336) |
| Inj. Temp.: | 275 °C |
| Oven | |
| Oven Temp.: | 40 °C (hold 1.5 min) to 280 °C at 20 °C/min to 320 °C at 5 °C/min (hold 1 min) |
| Carrier Gas | He, constant flow |
| Linear Velocity: | 39.5 cm/sec @ 40 °C |
| Detector | SRM/MRM |
|---|---|
| Acquisition Type: | SRM/MRM |
| Source Temp.: | 230 °C |
| Transfer Line Temp.: | 300 °C |
| Analyzer Type: | Triple Quadrupole |
| Ionization Mode: | EI |
| Collision Gas: | Ar |
| Tune Type: | PFTBA |
| Tune Emission Current: | 60 μA |
| Notes | Shimadzu Nexis GC-2030 with Shimadzu GCMS-TQ8050 NX ultra-fast mass spectrometer with EI source and UFsweeper high-efficiency collision cell |
| Acknowledgement | Shimadzu |
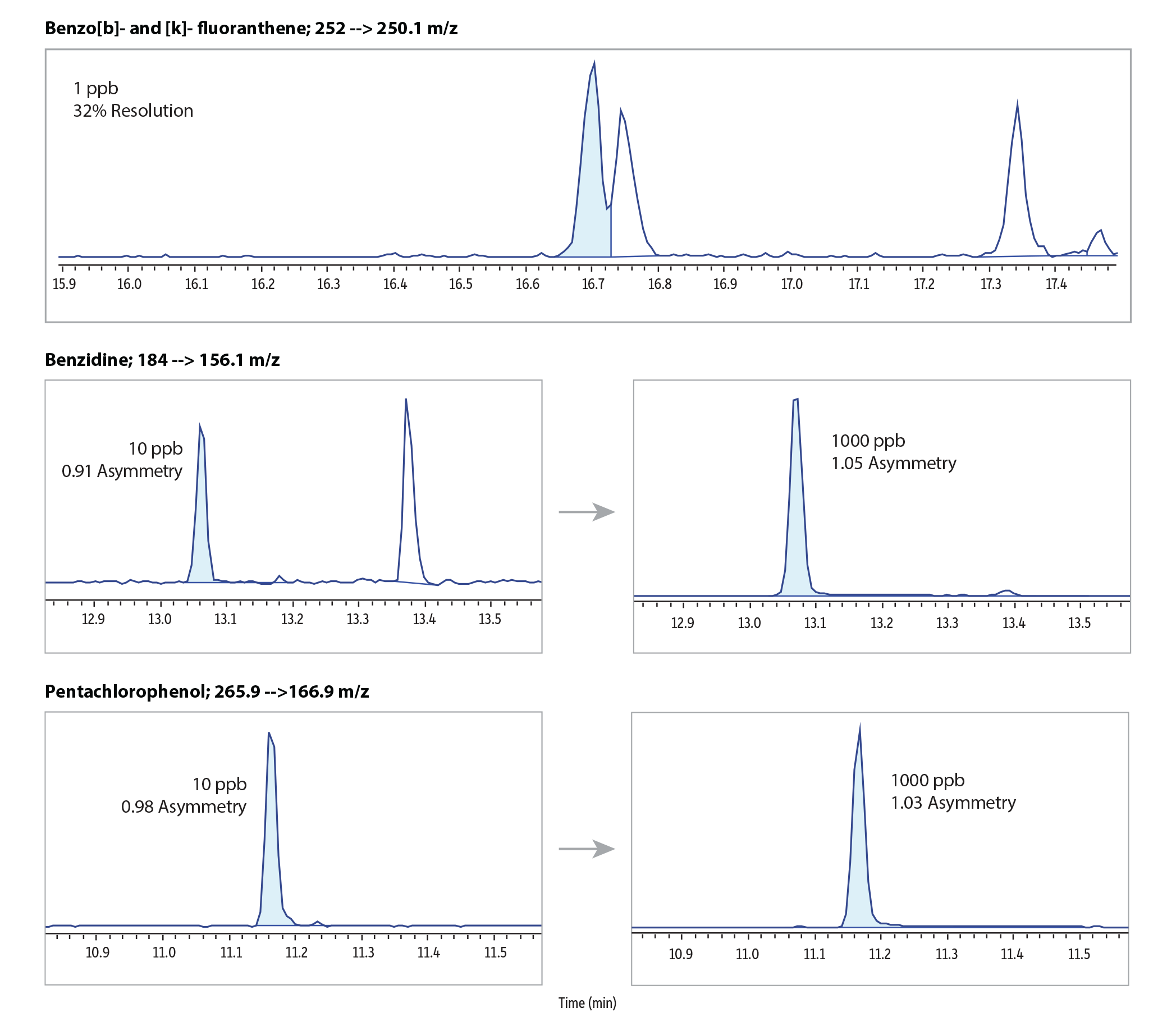
GC_EV1535
Peaks
| Peaks | tR (min) | Transition 1 | Collision energy 1 | Transition 2 | Collision energy 2 | |
|---|---|---|---|---|---|---|
| 1. | Benzidine | 13.062 | 184.00>156.10 | 24 | 184.00>167.10 | 24 |
| 2. | Benzo[b]fluoranthene | 16.691 | 252.10>250.10 | 36 | 250.10>248.10 | 36 |
| 3. | Benzo[k]fluoranthene | 16.746 | 252.10>250.10 | 36 | 250.10>248.10 | 36 |
| 4. | Pentachlorophenol | 11.159 | 265.90>164.90 | 26 | 265.90>166.90 | 26 |
Conditions
| Column | RMX-5Sil MS, 30 m, 0.25 mm ID, 0.25 µm (cat.# 17323) |
|---|---|
| Injection | |
| Inj. Vol.: | 1 µL split (split ratio 5:1) |
| Liner: | Topaz 3.5 mm ID single taper inlet liner w/wool (cat.# 23336) |
| Inj. Temp.: | 275 °C |
| Oven | |
| Oven Temp.: | 40 °C (hold 1.5 min) to 280 °C at 20 °C/min to 320 °C at 5 °C/min (hold 1 min) |
| Carrier Gas | He, constant flow |
| Linear Velocity: | 39.5 cm/sec @ 40 °C |
| Detector | SRM/MRM |
|---|---|
| Acquisition Type: | SRM/MRM |
| Source Temp.: | 230 °C |
| Transfer Line Temp.: | 300 °C |
| Analyzer Type: | Triple Quadrupole |
| Ionization Mode: | EI |
| Collision Gas: | Ar |
| Tune Type: | PFTBA |
| Tune Emission Current: | 60 μA |
| Notes | Shimadzu Nexis GC-2030 with Shimadzu GCMS-TQ8050 NX ultra-fast mass spectrometer with EI source and UFsweeper high-efficiency collision cell |
| Acknowledgement | Shimadzu |
Kalibrierleistung
AWie Tabelle II zeigt, liefert die Kombination aus Shimadzu-GC-MS/MS-System und hochinerter RMX-5Sil-MS-Säule eine hohe Empfindlichkeit im Spurenbereich für unterschiedlichste Klassen halbflüchtiger Verbindungen. Die Kalibrierungen waren über alle Verbindungen hinweg stabil und erfüllten die vorgegebenen Datenqualitätsziele; der relative Standardfehler (%RSE) lag durchgängig bei ≤ 20 %.
Für eine repräsentative Auswahl halbflüchtiger Verbindungen wurde zusätzlich der Bestimmtheitskoeffizient bestimmt. In allen Fällen lag R² bei mindestens 0,99. Die linearen Kalibrierbereiche reichten – abhängig von der Verbindung – von 1–1000 ppb bzw. 10–1000 ppb. Lediglich für Benzoesäure wurde ein höherer Einstiegsbereich von 50–1000 ppb gewählt, was aufgrund ihrer eingeschränkten Löslichkeit auf 5-Typ-Phasen zu erwarten war.
Auch bei der Nachweisgrenze zeigten sich durchweg sehr gute Ergebnisse. Für nahezu alle halbflüchtigen Verbindungen wurden instrumentelle Nachweisgrenzen von 1 pg oder weniger erreicht. Ausnahmen bildeten Benzoesäure (14,70 pg) und 2,4-Dinitrophenol (11,53 pg).
Tabelle II: Kalibrierleistung für die Analyse halbflüchtiger Verbindungen in Spurenkonzentrationen auf einer RMX-5Sil MS-Säule
| Verbindungsname | Retentionszeit(min) | %RSE der Kalibrierkurve | R2 | Niedriger Punkt (ppb) | Hoher Punkt (ppb) | Geräte-Nachweisgrenze (IDL) (pg) |
|---|---|---|---|---|---|---|
| N-Nitrosodimethylamin | 3.173 | 16.82 | 5 | 1000 | 2.14 | |
| Pyridin | 3.276 | 8.69 | 0.994 | 10 | 1000 | 3.23 |
| 2-Fluorophenol | 4.532 | 15.24 | 5 | 1000 | 0.28 | |
| Phenol | 5.514 | 19.25 | 1 | 1000 | 0.70 | |
| Phenol-d5 | 5.5 | 17.86 | 1 | 1000 | 0.29 | |
| Anilin | 5.554 | 9.52 | 0.993 | 10 | 1000 | 1.43 |
| Bis(2-chloroethyl)ether | 5.619 | 14.33 | 1 | 1000 | 0.42 | |
| 2-Chlorphenol | 5.688 | 19.78 | 1 | 1000 | 1.28 | |
| 1,3-Dichlorbenzol | 5.863 | 16.96 | 1 | 1000 | 0.36 | |
| 1,4-Dichlorbenzol | 5.944 | 17.90 | 1 | 1000 | 0.77 | |
| Benzylalkohol | 6.069 | 17.06 | 1 | 1000 | 0.98 | |
| 1,2-Dichlorbenzen | 6.116 | 17.32 | 1 | 1000 | 1.13 | |
| 2-Methylphenol | 6.194 | 19.48 | 10 | 1000 | 1.95 | |
| 2,2′-Oxybis(1-chlorpropan) | 6.229 | 19.32 | 10 | 1000 | 4.04 | |
| 3- and 4-Methylphenol | 6.369 | 19.71 | 1 | 1000 | 1.01 | |
| N-Nitrosodi-N-propylamin | 6.374 | 5.38 | 0.997 | 10 | 1000 | 3.10 |
| Hexachloroethan | 6.511 | 15.67 | 5 | 1000 | 1.36 | |
| Nitrobenzol | 6.563 | 12.10 | 0.996 | 5 | 1000 | 0.81 |
| Nitrobenzol-d5 | 6.541 | 17.81 | 1 | 1000 | 0.96 | |
| Isophorone | 6.846 | 18.92 | 1 | 1000 | 0.56 | |
| 2-Nitrophenol | 6.941 | 13.56 | 0.996 | 10 | 1000 | 1.26 |
| 2,4-Dimethylphenol | 6.99 | 19.63 | 1 | 1000 | 0.36 | |
| Benzoesäure | 7.019 | 3.84 | 0.998 | 50 | 1000 | 14.70 |
| Bis(2-chlorethoxy)methan | 7.102 | 14.01 | 1 | 1000 | 0.26 | |
| 2,4-Dichlorphenol | 7.223 | 18.99 | 1 | 1000 | 0.83 | |
| 1,2,4-Trichlorbenzol | 7.333 | 10.67 | 1 | 1000 | 0.46 | |
| Naphthalin | 7.424 | 8.68 | 1 | 1000 | 0.73 | |
| 2,6-Dichlorphenol | 7.223 | 18.18 | 1 | 1000 | 0.62 | |
| 4-Chloranilin | 7.484 | 13.85 | 0.998 | 5 | 1000 | 1.34 |
| Hexachlorbutadien | 7.59 | 13.96 | 1 | 1000 | 0.65 | |
| 4-Chlor-3-methylphenol | 8.072 | 16.99 | 1 | 1000 | 0.30 | |
| 2-Methylnaphthalin | 8.268 | 10.57 | 1 | 1000 | 0.63 | |
| 1-Methylnaphthalin | 8.388 | 18.50 | 1 | 1000 | 0.64 | |
| Hexachlorcyclopentadien | 8.474 | 16.59 | 0.998 | 5 | 1000 | 2.72 |
| 2,4,6-Trichlorphenol | 8.613 | 16.69 | 5 | 1000 | 1.55 | |
| 2,4,5-Trichlorphenol | 8.651 | 16.98 | 5 | 1000 | 0.76 | |
| 2-Fluorbiphenyl | 8.721 | 16.31 | 1 | 1000 | 1.05 | |
| 2-Chlornaphthalin | 8.862 | 14.23 | 1 | 1000 | 0.43 | |
| 2-Nitroanilin | 8.979 | 17.82 | 0.996 | 10 | 1000 | 1.33 |
| 1,4-Dinitrobenzol | 9.143 | 12.76 | 0.996 | 10 | 1000 | 8.63 |
| Dimethylphthalat | 9.216 | 18.60 | 1 | 1000 | 0.60 | |
| 1,3-Dinitrobenzol | 9.14 | 18.88 | 0.991 | 10 | 1000 | 6.97 |
| 2,6-Dinitrotoluol | 9.281 | 19.86 | 0.997 | 5 | 1000 | 2.06 |
| Acenapthylene | 9.374 | 11.73 | 1 | 1000 | 0.37 | |
| 3-Nitroanilin | 9.484 | 18.30 | 0.995 | 10 | 1000 | 2.89 |
| Acenaphthen | 9.592 | 9.44 | 0.991 | 1 | 1000 | 2.61 |
| 2,4-Dinitrophenol | 9.617 | 7.79 | 0.995 | 10 | 1000 | 11.53 |
| 4-Nitrophenol | 9.689 | 14.01 | 0.998 | 10 | 1000 | 4.39 |
| 2,4-Dinitrotoluol | 9.778 | 14.84 | 0.999 | 10 | 1000 | 4.30 |
| Dibenzofuran | 9.805 | 9.94 | 1 | 1000 | 0.38 | |
| 2,3,5,6-Tetrachlorphenol | 9.904 | 16.86 | 5 | 1000 | 2.37 | |
| 2,3,4,6-Tetrachlorphenol | 9.958 | 17.72 | 0.997 | 5 | 1000 | 1.74 |
| Diethylphthalat | 10.093 | 15.97 | 1 | 1000 | 0.67 | |
| 4-Chlorphenylphenyl ether | 10.234 | 7.21 | 1 | 1000 | 0.57 | |
| Fluoren | 10.23 | 14.54 | 1 | 1000 | 0.37 | |
| 4-Nitroanilin | 10.234 | 18.81 | 0.993 | 10 | 1000 | 2.33 |
| 4,6-Dinitro-2-methylphenol | 10.283 | 19.99 | 0.996 | 10 | 1000 | 7.99 |
| N-Nitrosodiphenylamin | 10.376 | 18.03 | 1 | 1000 | 0.53 | |
| Diphenylamin | 10.376 | 18.03 | 1 | 1000 | 0.53 | |
| Diphenylhydrazin | 10.429 | 14.83 | 10 | 1000 | 3.39 | |
| 2,4,6-Tribromphenol | 10.524 | 18.55 | 0.997 | 5 | 1000 | 4.15 |
| 4-Bromophenyl phenyl ether | 10.839 | 15.84 | 1 | 1000 | 0.74 | |
| Hexachlorobenzol | 10.922 | 12.99 | 1 | 1000 | 0.96 | |
| Pentachlorphenol | 11.159 | 16.75 | 0.997 | 5 | 1000 | 1.14 |
| Phenanthren | 11.421 | 13.06 | 1 | 1000 | 0.18 | |
| Anthracen | 11.484 | 15.30 | 1 | 1000 | 0.92 | |
| Carbazol | 11.68 | 14.68 | 1 | 1000 | 0.52 | |
| Di-n-butylphthalat | 12.131 | 15.80 | 5 | 1000 | 0.25 | |
| Fluoranthen | 12.9 | 10.80 | 1 | 1000 | 0.26 | |
| Benzidin | 13.062 | 19.24 | 0.998 | 10 | 1000 | 1.43 |
| Pyren | 13.18 | 10.13 | 1 | 1000 | 0.54 | |
| o-Terphenyl-D14 | 13.377 | 13.45 | 1 | 1000 | 0.62 | |
| Butylbenzylphthalat | 14.012 | 15.67 | 5 | 1000 | 0.76 | |
| Bis(2-ethylhexyl)adipat | 14.129 | 18.95 | 0.994 | 10 | 1000 | 1.15 |
| 3’3-Dichlorbenzidin | 14.769 | 17.70 | 0.996 | 10 | 1000 | 1.76 |
| Benz[a]anthracen | 14.805 | 11.61 | 1 | 1000 | 0.38 | |
| Bis(2-ethylhexyl)phthalat | 14.875 | 19.67 | 5 | 1000 | 0.58 | |
| Chrysen | 14.861 | 8.91 | 1 | 1000 | 0.34 | |
| Di-n-octylphthalat | 16 | 18.78 | 0.998 | 5 | 1000 | 0.49 |
| Benzo[b]fluoranthen | 16.691 | 11.15 | 1 | 1000 | 0.41 | |
| Benzo[k]fluoranthen | 16.746 | 13.09 | 1 | 1000 | 0.50 | |
| Benzo[a]pyren | 17.338 | 12.32 | 1 | 1000 | 0.24 | |
| Dibenz[a,j]acridin | 19.26 | 19.92 | 1 | 1000 | 0.60 | |
| Indeno[1,2,3-cd]pyren | 19.754 | 15.17 | 1 | 1000 | 0.71 | |
| Dibenz[a,h]anthracen | 19.813 | 13.06 | 1 | 1000 | 0.56 | |
| Benzo[g,h,i]perylen | 20.339 | 10.79 | 1 | 1000 | 0.50 |
Schlussfolgerung
Die Ergebnisse dieser Studie zeigen deutlich, dass sich RMX-5Sil-MS-Säulen sehr gut für die GC-MS/MS-Analyse halbflüchtiger Verbindungen im Spurenbereich eignen, also bei Konzentrationen im einstelligen ppb-Bereich. Über die gesamte Analytliste hinweg zeigte die Säule eine hohe Inertheit gegenüber sauren, basischen und neutralen Verbindungen und lieferte durchweg stabile, lineare Kalibrierungen.
Besonders bemerkenswert ist, dass Peakform und -symmetrie auch bei niedrigen Konzentrationen erhalten blieben, bei denen reaktive Analyten üblicherweise problematisch sind. Für 98 % der untersuchten Verbindungen wurden instrumentelle Nachweisgrenzen von 1 pg oder weniger erreicht. Gleichzeitig erstreckten sich die linearen Kalibrierbereiche – je nach Analyt – von 1, 5 oder 10 ppb bis 1000 ppb, bei relativen Standardfehlern der Kalibrierkurven von höchstens 20 %.
Literaturhinweise
- U.S. Environmental Protection Agency, Method 8270E, Semivolatile organic compounds by gas chromatography/mass spectrometry, Juni 2018. https://www.epa.gov/sites/default/files/2020-10/documents/method_8270e_update_vi_06-2018_0.pdf
- U.S. Environmental Protection Agency, Method 3511 (SW-846), Organic compounds in water by microextraction, Juli 2014. https://www.epa.gov/hw-sw846/sw-846-test-method-3511-organic-compounds-water-microextraction