Key Highlights
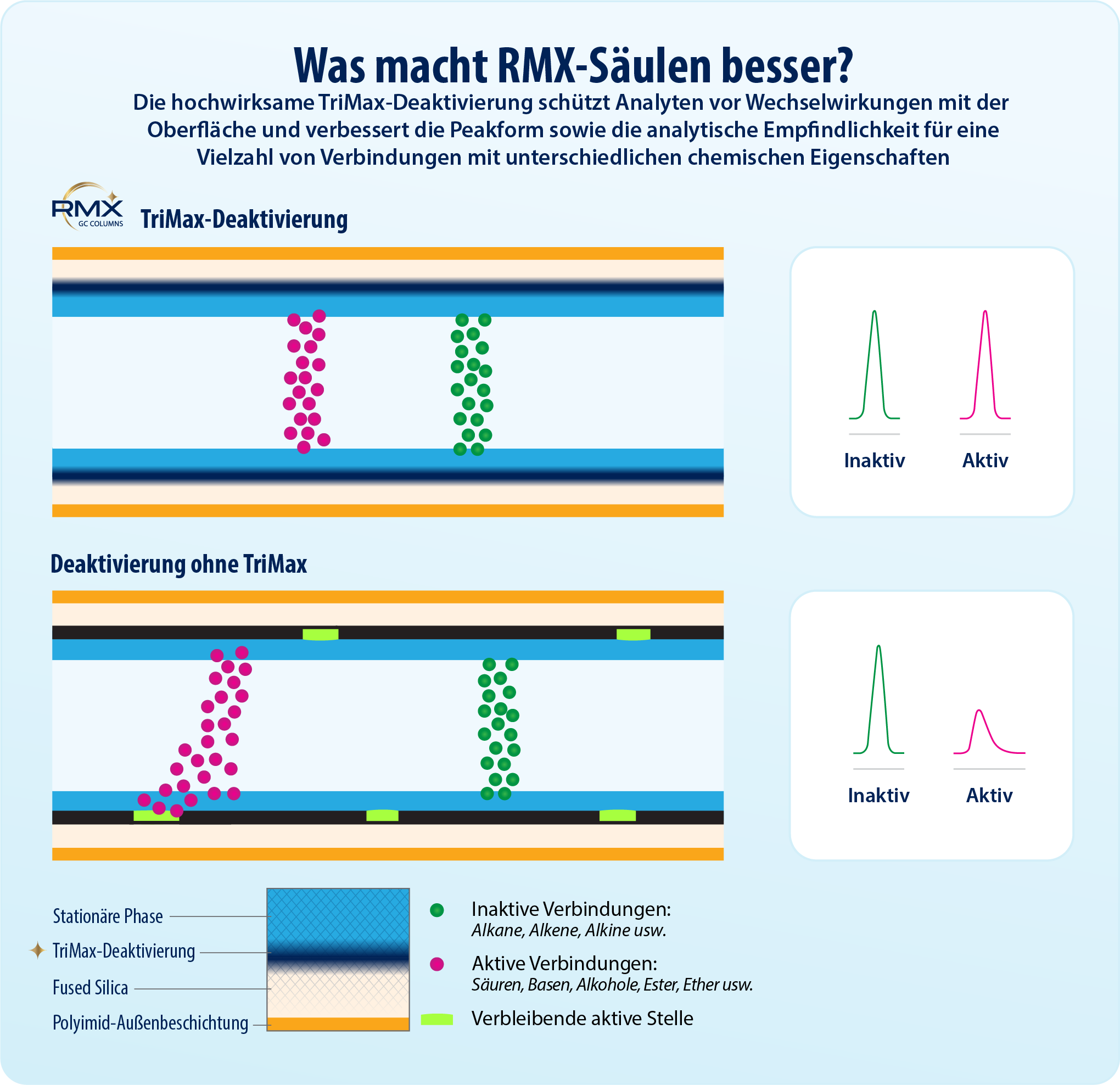
- Eine neue Generation der Deaktivierung: Die TriMax-Technologie schafft einen außergewöhnlich stabilen und hochinerten Probenflussweg – die Grundlage für zuverlässige Spurenanalytik.
- Saubere Peakformen bis in den Pikogrammbereich: Die hohe Inertheit verbessert die Peaksymmetrie über zahlreiche halbflüchtige Verbindungsklassen hinweg und eröffnet niedrigere Kalibrierbereiche bei gleichzeitig hoher analytischer Empfindlichkeit.
- Mehr Analytik in einer Methode: Die hohe Säulenperformance unterstützt umfangreiche Analytenlisten und reduziert den Bedarf an mehreren, spezialisierten Säulen.


Zusammenfassung
Diese Studie untersucht den Einfluss der neu entwickelten TriMax-Deaktivierung auf die GC-MS/MS-Analyse halbflüchtiger Verbindungen. Verglichen wurde die Leistungsfähigkeit von vier häufig eingesetzten analytischen Säulen. Die Bewertung erfolgte anhand von Peakasymmetrie, Kalibrierungslinearität, Wiederfindung und Reproduzierbarkeit. Untersucht wurden Verbindungen mit sehr unterschiedlichen chemischen Eigenschaften.
Die Ergebnisse zeigen, dass RMX-5Sil MS-Säulen mit TriMax-Deaktivierung eine deutlich inertere Oberfläche aufweisen als die Vergleichssäulen. Die Leistungsanforderungen wurden dabei für saure, basische und neutrale halbflüchtige Verbindungen erfüllt. Andere Säulen erreichten diese Kriterien jeweils nur für einzelne Verbindungsklassen.
Die gleichbleibend hohe Performance bei niedrigen Konzentrationen eröffnet Laboren neue Möglichkeiten. Arbeitsabläufe lassen sich vereinfachen, etwa durch reduzierte Probenextraktionsschritte oder die Konsolidierung von Methoden. Mit der TriMax-Deaktivierung werden zudem Aktivitätseffekte überwunden, die bei Säulen anderer Hersteller die quantitative Leistungsfähigkeit nachweislich begrenzen.
Einführung
Halbflüchtige organische Verbindungen (SVOCs) werden weltweit routinemäßig in Umweltproben überwacht. Ausschlaggebend dafür sind ihre weite Verbreitung und ihr potenzielles Risiko für die menschliche Gesundheit. Für diese Analysen haben sich GC-MS- und GC-MS/MS-Verfahren als Standard etabliert.
Der Einsatz von GC-MS/MS bietet dabei einen entscheidenden Vorteil: Die höhere Empfindlichkeit erlaubt niedrigere Nachweisgrenzen. Gleichzeitig lassen sich die Probenextraktionsvolumina reduzieren, was sowohl Zeit als auch Lösemittel spart. Extraktionsverfahren mit geringem Volumen sind meist einfacher und benötigen deutlich weniger Lösungsmittel, etwa Dichlormethan, als klassische Ansätze. Da die resultierenden Extrakte jedoch weniger konzentriert sind, greifen viele Labore gezielt auf GC-MS/MS zurück, um die analytische Leistungsfähigkeit dennoch sicherzustellen.
SVOCs bilden eine chemisch sehr heterogene Stoffgruppe. Einige dieser Verbindungen neigen dazu, mit aktiven Stellen im Probenflussweg zu wechselwirken, etwa mit Silanolgruppen. Solche Effekte machen sich besonders bei sehr niedrigen Konzentrationen bemerkbar und können den zuverlässigen Nachweis erschweren. In der Praxis werden daher häufig unterschiedliche GC-Säulen für verschiedene Zielanalyten eingesetzt. Verbreitet sind Säulen des Typs „5“ oder „5Sil“ mit mittlerer Polarität.
Mit steigenden Anforderungen an Empfindlichkeit und Nachweisgrenzen treten jedoch die Unterschiede zwischen den Herstellungsverfahren dieser Säulen zunehmend in den Vordergrund. Während neutrale Verbindungen meist kaum auf verbliebene aktive Stellen reagieren, zeigen saure und basische Analyten bereits bei geringsten Inhomogenitäten deutliche Effekte. Da sowohl basische Verbindungen wie Benzidin als auch saure Verbindungen wie Pentachlorphenol fester Bestandteil von Systemtauglichkeitsprüfungen sind und zugleich immer niedrigere Kalibrierbereiche gefordert werden, rückt die Oberflächeninertheit von GC-Säulen verstärkt in den Fokus.
GC-Säulen mit einer breit wirksamen Deaktivierung gewinnen vor diesem Hintergrund zunehmend an Bedeutung. Sie ermöglichen verlässliche Ergebnisse für saure, basische und neutrale halbflüchtige Verbindungen gleichermaßen. Zudem schaffen sie die Voraussetzung, Arbeitsabläufe zu vereinfachen – etwa durch geringeren Lösemittelverbrauch, stabile Geräteleistung und eine stärkere Konsolidierung analytischer Methoden.
In dieser Studie wurde die Leistungsfähigkeit der RMX-5Sil MS-Säule mit mehrerer GC-Säulen verglichen, die in der Routineanalytik halbflüchtiger Verbindungen häufig eingesetzt werden. Ein zentrales Unterscheidungsmerkmal der RMX-5Sil MS-Säule ist die spezielle Deaktivierung der Säulenoberfläche auf Basis der TriMax-Technologie. Dabei werden aktive Stellen gezielt durch eine robuste Polymerbeschichtung eliminiert, sodass ein hochgradig inerter Probenflussweg entsteht.
Trotz dieser modifizierten Oberfläche basiert die RMX-5Sil MS-Säule weiterhin auf einem klassischen 5Sil-Polymer und kann daher als direkter Ersatz für herkömmliche 5Sil-Säulen eingesetzt werden. Die deutlich erhöhte Oberflächeninertheit wirkt sich jedoch spürbar auf die chromatografische Performance aus. Sie verbessert die Peakform über eine Vielzahl von Verbindungsklassen hinweg und ermöglicht stabile Kalibrierungen bis in den Spurenbereich, ohne Abstriche bei der Datenqualität.
Experimenteller Teil
Standard- und Probenvorbereitung
Kalibrierstandards, die sauren, basischen und neutralen halbflüchtigen Verbindungen enthielten, wurden in Dichlormethan in Konzentrationen von 0.5 bis 5000 ppb hergestellt, um den niedrigsten linearen Kalibrierbereich für jeden Analyten zu bestimmen. Für jede Säule wurden frische Kalibrierstandards hergestellt. Außerdem wurden Standards für die Wiederfindungsprüfung im mittleren Bereich bei 50 ppb hergestellt.
Gerät
Die Proben wurden auf vier Arten von Säulen (RMX-5Sil MS, zwei Premium-Säulen eines Mitbewerbers und eine herkömmliche Säule eines Mitbewerbers) in der Dimension 30 m, 0.25 mm ID und 0.25 μm getestet. Ein Thermo TRACE 1310 GC in Verbindung mit einem TSQ 8000 Massenspektrometer wurde für die Analyse halbflüchtiger Verbindungen unter den unten aufgeführten Bedingungen verwendet. Die verwendeten Bedingungen wurden vereinfacht, um eine Standardisierung und einen direkten Vergleich der getesteten Säulen zu ermöglichen. Bei Routinearbeiten können andere Einstellungen für den Inlet, den Ofen oder den Detektor verwendet werden, um die chromatografischen Ergebnisse weiter zu verbessern. Die optimierten Bedingungen werden in einer separaten Studie mit sehr niedrigen Konzentrationen dargelegt, die eine erweiterte Liste von 150 häufig analysierten halbflüchtigen Verbindungen umfasst [1].
Injektionsvolumen: 1 µL
Liner: Topaz 4 mm Precision Inlet Liner m. Glaswolle (Art.-Nr. 23267) Injektionsport: 250 °C; 5:1 Split; 1.2 mL/min
Trägergas:Helium
Ofentemperatur:40 °C (1 min) auf 280 °C mit 12.4 °C/min auf 315 °C mit 3.3 °C/min (1 min)
Detektor: MS/MS; SRM-Modus; Temperatur der Transferleitung 280 °C; Quelle 330 °C (SRM-Übergänge siehe Abbildung 1)
Bewertung der Datenqualität
Die Datenqualität wurde anhand mehrerer Kriterien bewertet: Peakasymmetrie, Linearität, Wiederfindung und Reproduzierbarkeit. Für jede dieser Kenngrößen wurde die Gesamtleistung gemäß den in Tabelle I definierten Kriterien eingestuft.
Die Peakasymmetrie wurde für jede Verbindung als Maß für die Inertheit der Säule herangezogen. Die Linearität wurde sowohl über den Bestimmtheitskoeffizienten (R²) als auch über den relativen Standardfehler (%RSE) beurteilt. Die Wiederfindung wurde für jeden Analyten am niedrigsten Kalibrierpunkt (LCP) sowie bei 50 ppb bestimmt. Der Messpunkt bei 50 ppb diente zugleich zur Bewertung der Reproduzierbarkeit der Wiederfindung.
Tabelle I: Klassifizierungen der Datenqualität
| Ideal | Akzeptabel | Schlecht | |
|---|---|---|---|
| Asymmetrie | 0.9-1.2 | 0.5-0.9 oder 1.2-2 | <0.5, >2 |
| Linearität (R2) | >0.995 | 0.990-0.995 | <0.990 |
| Linearität (%RSD) | <10% | 11-20% | >20% |
| Wiederfindung (LCP) | 70-130% | 50-69% oder 131-200% | <50%, >200% |
| Wiederfindung (50 ppb) | 70-130% | 50-69% oder 131-200% | <50%, >200% |
| Wiederholbarkeit (%RSD bei 50 ppb) | <10% | 11-20% | >20% |
Ergebnisse und Diskussion
Chromatografische Performance
Silanolgruppen zählen zu den häufigsten Ursachen für aktive Stellen auf der Fused-Silica-Oberfläche von GC-Säulen. Um ihre Auswirkungen zu minimieren, setzen Säulenhersteller unterschiedliche Deaktivierungsverfahren ein. Ist diese Deaktivierung jedoch nicht ausreichend wirksam, können Analyten mit den verbleibenden Silanolen wechselwirken. Die Folge sind eine verzögerte oder ungleichmäßige Desorption aus der stationären Phase, Peaktailing sowie weitere Effekte wie Retentionszeitverschiebungen und eine verminderte Empfindlichkeit.
Besonders betroffen sind saure und basische Verbindungen. Phenole können über Wasserstoffbrückenbindungen an Silanolgruppen binden, während basische Analyten wie Benzidin Säure-Base-Wechselwirkungen mit der Säulenoberfläche eingehen. Eine zentrale Herausforderung bei der Analyse halbflüchtiger Verbindungen liegt darin, dass sie viele unterschiedliche Verbindungsklassen umfassen. Diese interagieren über verschiedene Mechanismen und in unterschiedlicher Stärke mit aktiven Stellen, sodass eine Säulendeaktivierung breit und zuverlässig wirken muss.
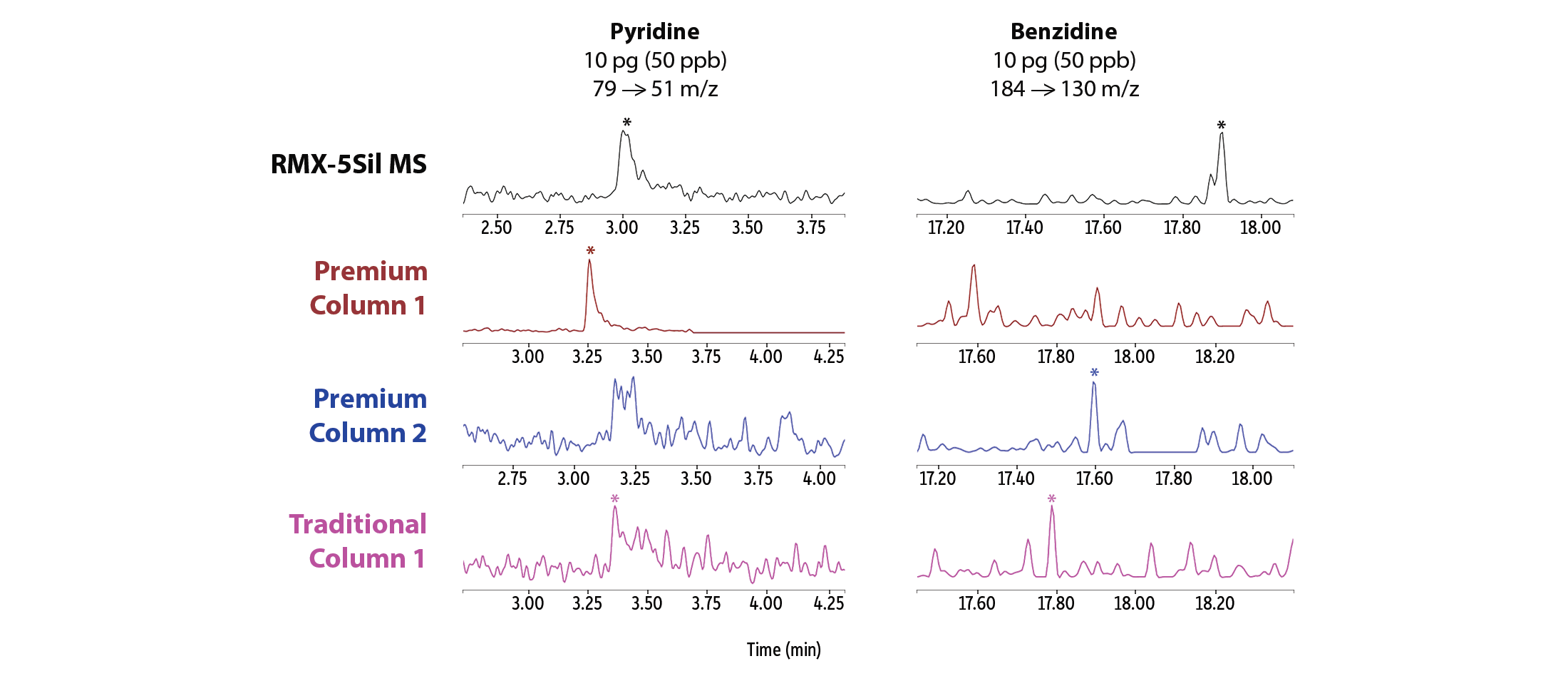
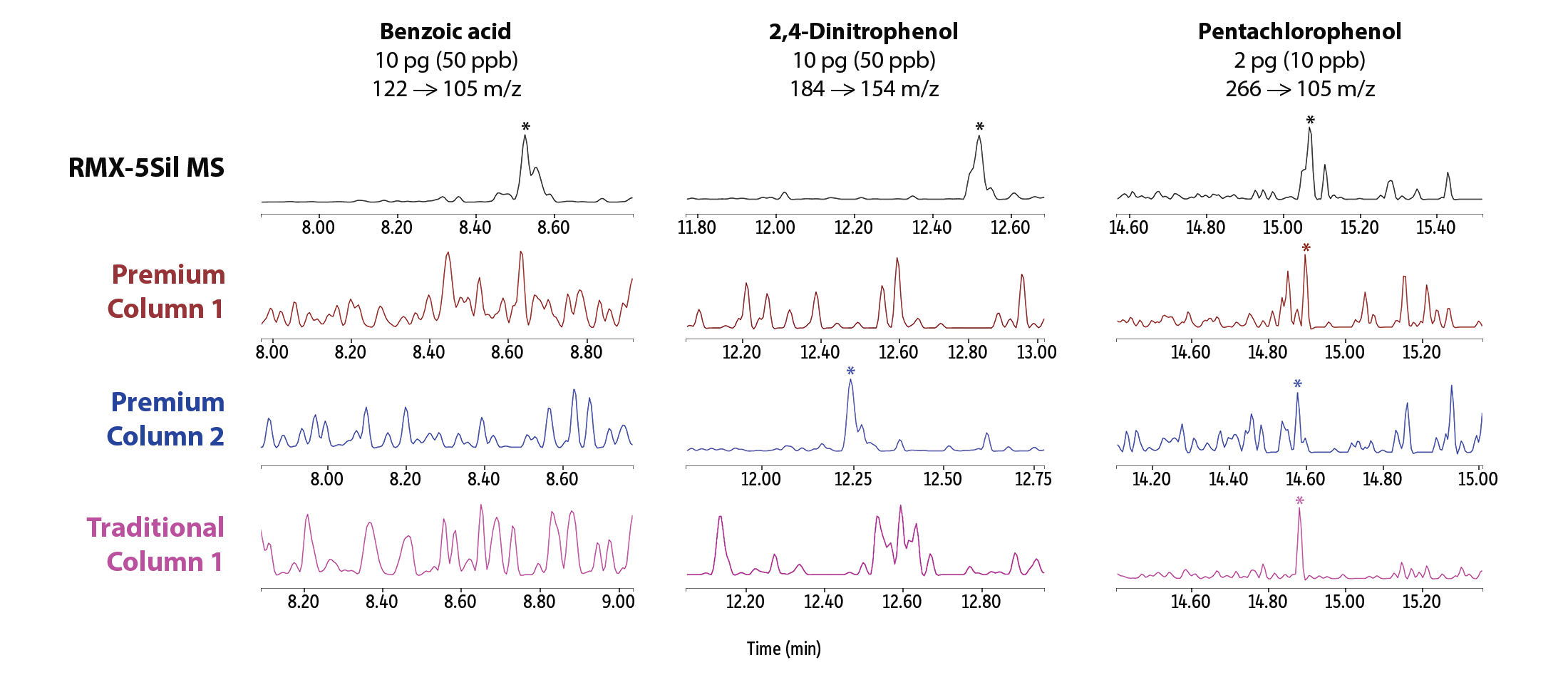
Um die Silanolaktivität gezielt und dauerhaft zu unterdrücken, wurde für alle RMX-Säulen die TriMax-Deaktivierung der nächsten Generation entwickelt. Dabei wird die Oberflächenaktivität durch eine robuste Polymer–Fused-Silica-Grenzfläche deutlich reduziert, sodass Wechselwirkungen zwischen Analyten und Silanolgruppen wirksam verhindert werden. Wie in Abbildung 1 gezeigt, resultiert daraus eine durchgängig hohe chromatografische Performance mit scharfen, symmetrischen Peaks – auch für bekannte problematische Verbindungen wie 2,4-Dinitrophenol (2,4-DNP), Pentachlorphenol und Benzidin.
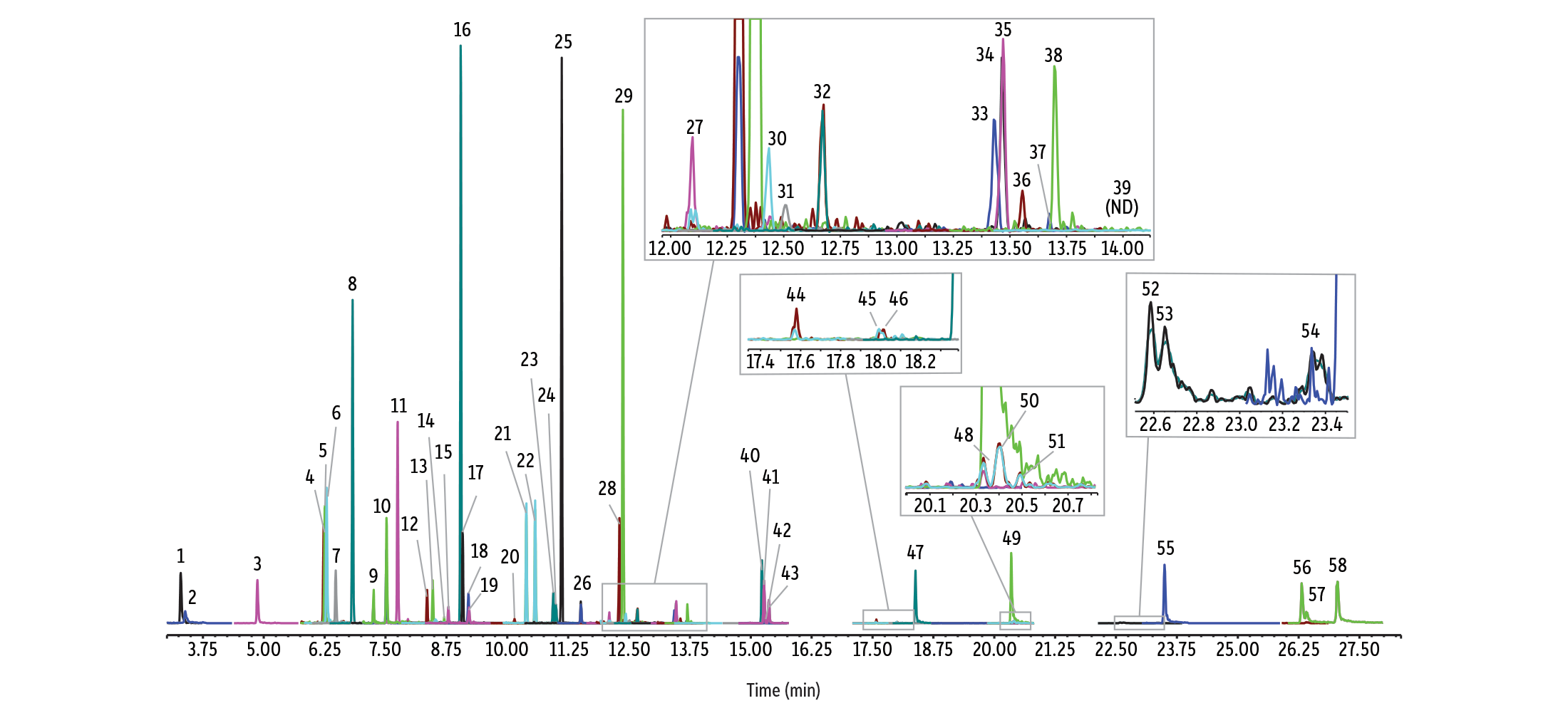
GC_EV1528
Peaks
| Peaks | tR (min) | Conc. (ng/mL) | Mass 1 | Product 1 | Collision energy 1 | Mass 2 | Product 2 | Collision energy 2 | |
|---|---|---|---|---|---|---|---|---|---|
| 1. | N-Nitrosodimethylamine | 3.55 | 50 | 74 | 44 | 6 | 74 | 42 | 16 |
| 2. | Pyridine | 3.59 | 50 | 79 | 51 | 26 | 52 | 26 | 18 |
| 3. | 2-Fluorophenol | 5.03 | 50 | 112 | 92 | 6 | 92 | 63 | 14 |
| 4. | Phenol-d6 | 6.37 | 50 | 99 | 71 | 8 | 99 | 69 | 18 |
| 5. | Phenol | 6.40 | 50 | 94 | 66 | 10 | 94 | 65 | 16 |
| 6. | Aniline | 6.45 | 50 | 93 | 66 | 10 | 93 | 65 | 20 |
| 7. | 2-Chlorophenol | 6.62 | 50 | 128 | 64 | 14 | 128 | 63 | 24 |
| 8. | 1,4-Dichlorobenzene-d4 | 6.96 | 100 | 150 | 115 | 14 | 150 | 78 | 26 |
| 9. | 2-Methylphenol | 7.38 | 50 | 108 | 80 | 8 | 108 | 77 | 24 |
| 10. | 3- and 4-Methylphenol | 7.66 | 50 | 70 | 43 | 6 | 107 | 77 | 14 |
| 11. | Nitrobenzene-d5 | 7.89 | 50 | 128 | 82 | 12 | 128 | 54 | 28 |
| 12. | 2-Nitrophenol | 8.54 | 50 | 139 | 81 | 12 | 139 | 109 | 8 |
| 13. | 2,4-Dimethylphenol | 8.61 | 50 | 122 | 107 | 12 | 122 | 77 | 20 |
| 14. | Benzoic acid | 8.72 | 50 | 122 | 105 | 8 | 122 | 77 | 20 |
| 15. | 2,4-Dichlorophenol | 8.95 | 50 | 162 | 63 | 24 | 162 | 98 | 12 |
| 16. | Naphthalene-d8 | 9.18 | 100 | 136 | 134 | 14 | 136 | 108 | 18 |
| 17. | Naphthalene | 9.23 | 50 | 128 | 102 | 16 | 129 | 103 | 14 |
| 18. | 4-Chloroaniline | 9.35 | 50 | 127 | 100 | 10 | 127 | 65 | 20 |
| 19. | 2,6-Dichlorophenol | 9.37 | 50 | 162 | 63 | 24 | 164 | 63 | 26 |
| 20. | 4-Chloro-3-methylphenol | 10.28 | 50 | 142 | 107 | 12 | 107 | 77 | 12 |
| 21. | 2-Methylnaphthalene | 10.53 | 50 | 141 | 115 | 16 | 141 | 89 | 30 |
| 22. | 1-Methylnaphthalene | 10.71 | 50 | 141 | 115 | 16 | 141 | 89 | 30 |
| 23. | 2,4,6-Trichlorophenol | 11.09 | 50 | 132 | 97 | 10 | 196 | 97 | 24 |
| 24. | 2,4,5-Trichlorophenol | 11.09 | 50 | 132 | 97 | 10 | 196 | 97 | 24 |
| 25. | 2-Fluorobiphenyl | 11.26 | 50 | 172 | 171 | 12 | 172 | 170 | 22 |
| 26. | o-Nitroaniline | 11.66 | 50 | 138 | 92 | 12 | 138 | 65 | 22 |
| 27. | Acenaphthylene | 12.24 | 50 | 152 | 102 | 26 | 152 | 76 | 36 |
| 28. | 3-Nitroaniline | 12.49 | 50 | 138 | 92 | 12 | 138 | 65 | 20 |
| 29. | Acenaphthene-d10 | 12.53 | 100 | 162 | 160 | 18 | 164 | 162 | 14 |
| 30. | Acenaphthene | 12.60 | 50 | 153 | 126 | 36 | 153 | 77 | 38 |
| 31. | 2,4-Dinitrophenol | 12.70 | 50 | 184 | 154 | 6 | 154 | 79 | 12 |
| 32. | 4-Nitrophenol | 12.90 | 50 | 139 | 109 | 6 | 139 | 81 | 14 |
| 33. | 2,3,4,6-Tetrachlorophenol | 13.21 | 50 | 232 | 168 | 12 | 234 | 131 | 24 |
| 34. | 4-Nitroaniline | 13.60 | 50 | 138 | 108 | 8 | 138 | 80 | 18 |
| 35. | Fluorene | 13.61 | 50 | 165 | 115 | 24 | 165 | 139 | 26 |
| 36. | 4,6-Dinitro-2-methylphenol | 13.71 | 50 | 198 | 168 | 6 | 198 | 121 | 10 |
| 37. | Diphenylamine | 13.88 | 50 | 169 | 66 | 22 | 170 | 66 | 22 |
| 38. | 2,4,6-Tribromophenol | 14.10 | 50 | 330 | 141 | 36 | 332 | 143 | 34 |
| 39. | Pentachlorophenol | 15.04 | 50 | 228 | 165 | 14 | 270 | 169 | 22 |
| 40. | Phenanthrene-d10 | 15.40 | 100 | 188 | 160 | 20 | 184 | 156 | 22 |
| 41. | Phenanthrene | 15.46 | 50 | 178 | 152 | 18 | 178 | 151 | 32 |
| 42. | Dinoseb | 15.49 | 50 | 163 | 116 | 14 | 240 | 211 | 8 |
| 43. | Anthracene | 15.54 | 50 | 178 | 152 | 18 | 177 | 151 | 18 |
| 44. | Fluoranthene | 17.78 | 50 | 202 | 176 | 26 | 202 | 152 | 30 |
| 45. | Benzidine | 18.05 | 50 | 184 | 156 | 18 | 184 | 166 | 16 |
| 46. | Pyrene | 18.20 | 50 | 200 | 174 | 22 | 200 | 149 | 34 |
| 47. | p-Terphenyl-d14 | 18.57 | 50 | 244 | 242 | 14 | 244 | 240 | 22 |
| 48. | 3,3′-Dichlorobenzidine | 20.53 | 50 | 252 | 154 | 26 | 252 | 181 | 22 |
| 49. | Chrysene-d12 | 20.55 | 100 | 240 | 238 | 14 | 240 | 236 | 30 |
| 50. | Benz[a]anthracene | 20.63 | 50 | 228 | 202 | 22 | 226 | 200 | 28 |
| 51. | Chrysene | 20.63 | 50 | 228 | 202 | 22 | 228 | 201 | 36 |
| 52. | Benzo[b]fluoranthene | 22.90 | 50 | 252 | 226 | 22 | 250 | 224 | 24 |
| 53. | Benzo[k]fluoranthene | 22.91 | 50 | 252 | 226 | 22 | 250 | 224 | 24 |
| 54. | Benzo[a]pyrene | 23.66 | 50 | 252 | 226 | 22 | 250 | 224 | 26 |
| 55. | Perylene-d12 | 23.81 | 100 | 264 | 262 | 20 | 264 | 260 | 34 |
| 56. | Indeno[1,2,3-cd]pyrene | 26.74 | 50 | 276 | 274 | 38 | 276 | 250 | 30 |
| 57. | Dibenz[a,h]anthracene | 26.80 | 50 | 139 | 126 | 8 | 139 | 113 | 14 |
| 58. | Benzo[ghi]perylene | 27.47 | 50 | 276 | 274 | 38 | 138 | 125 | 12 |
Conditions
| Column | RMX-5Sil MS, 30 m, 0.25 mm ID, 0.25 µm (cat.# 17323) |
|---|---|
| Standard/Sample | |
| 8270 Calibration mix #1 (cat.# 31618) | |
| 8270 Calibration mix #2 (cat.# 31619) | |
| 8270 Calibration mix #5 (cat.# 31995) | |
| Base neutral surrogate mix (4/89 SOW) (cat.# 31024) | |
| Acid surrogate mix (4/89 SOW) (cat.# 31025) | |
| Revised SV internal standard mix (cat.# 31886) | |
| Diluent: | Dichloromethane |
| Conc.: | 50 ppb (100 ppb internal standards) |
| Injection | |
| Inj. Vol.: | 1 µL split (split ratio 5:1) |
| Liner: | Topaz 4.0 mm ID Precision liner w/wool (cat.# 23267) |
| Inj. Temp.: | 250 °C |
| Split Vent Flow Rate: | 6 mL/min |
| Oven | |
| Oven Temp.: | 40 °C (hold 1 min) to 280 °C at 12.4 °C/min to 315 °C at 3.3 °C/min (hold 1 min) |
| Carrier Gas | He, constant flow |
| Flow Rate: | 1.2 mL/min @ 40 °C |
| Detector | SRM/MRM |
|---|---|
| Acquisition Type: | SRM/MRM |
| Source Temp.: | 330 °C |
| Transfer Line Temp.: | 280 °C |
| Analyzer Type: | Triple Quadrupole |
| Ionization Mode: | EI |
| Collision Gas: | Ar |
| Tune Type: | PFTBA |
| Tune Emission Current: | 70 μA |
| Instrument | Thermo Scientific TSQ 8000 Triple Quadrupole GC-MS |
| Sample Preparation | Standards were combined and diluted to a concentration of 50 ppb with internal standards added at 100 ppb. |
Um die Inertheit der RMX-5Sil MS-Säule mit der anderer, in der SVOC-Analytik häufig eingesetzter GC-Säulen zu vergleichen, wurde die Peakasymmetrie unter standardisierten Bedingungen bei einer Konzentration von 50 ppb bewertet. Dieser Konzentrationsbereich wurde bewusst gewählt, da er im mittleren Kalibrierbereich liegt und eine aussagekräftige Beurteilung der Asymmetrie erlaubt. Gleichzeitig werden Effekte berücksichtigt, die bei sehr niedrigen Konzentrationen durch ein Übergehen des Peaktailings in die Baseline maskiert sein können.
Wie Abbildung 2 zeigt, erreichte die RMX-5Sil MS-Säule für saure, basische und neutrale halbflüchtige Verbindungen bei einer größeren Zahl von Analyten ideale Peakasymmetrien als alle anderen untersuchten Säulen. Besonders deutlich war dieser Unterschied bei sauren und basischen Verbindungen. Dies erleichtert eine zuverlässige Identifizierung und Quantifizierung über ein breites SVOC-Spektrum hinweg und schafft die Voraussetzung, mehrere Analytenklassen in einem einzigen Lauf zu erfassen – ein klarer Vorteil für die Konsolidierung analytischer Methoden.
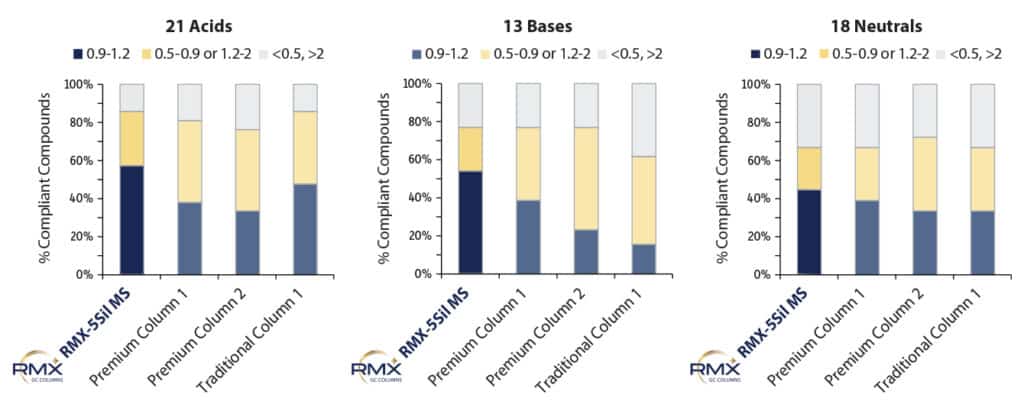
Neben der insgesamt verbesserten Peakasymmetrie zeigten sich bei sehr niedrigen Konzentrationen auch deutlich stärkere Peaksignale für mehrere halbflüchtige Verbindungen, die als analytisch besonders anspruchsvoll gelten (Abbildung 3). Auf der RMX-5Sil MS-Säule ließen sich unter anderem Pyridin, Benzidin, Benzoesäure, 2,4-Dinitrophenol und Pentachlorphenol mit klar definierten Peaks erfassen, die eine zuverlässige Software-Integration ermöglichen. Während einige Vergleichssäulen für einzelne Verbindungen ähnliche Ergebnisse lieferten, fiel die Performance bei anderen Analyten deutlich ab. Die sichtbaren Unterschiede in der Peakform verdeutlichen, dass die durch die RMX TriMax-Deaktivierung erzielte Inertheit wirksamer ist als bei herkömmlichen Deaktivierungsverfahren, wie sie in anderen Säulen zum Einsatz kommen.
Linearität
Eine gute Peaksymmetrie erleichtert die Integration und verbessert das resultierende Signal-Rausch-Verhältnis. Dadurch lassen sich lineare Kalibrierungen bis in niedrigere Konzentrationsbereiche realisieren. Die linearen Kalibrierbereiche der einzelnen halbflüchtigen Verbindungen wurden auf der RMX-5Sil MS-Säule bestimmt und variierten je nach Analyt (Tabelle II). Je nach Verbindung umfassten die Kalibrierungen zwischen fünf und elf Kalibrierpunkte. Die niedrigsten Kalibrierkonzentrationen lagen zwischen 0,5 und 100 ppb, was 0,1 bis 20 pg auf der Säule entspricht. Da die Linearität einer Kalibrierung stark von der Peakform und der Integration abhängt, wurden die Integrationseinstellungen für alle Säulen konstant gehalten. Nähern sich Peaks der Baseline oder zeigen ausgeprägtes Tailing, ist häufig eine manuelle Integration erforderlich. Dies erhöht den zeitlichen Aufwand pro Probe deutlich. Zwar lassen sich solche Effekte durch alternative Kalibriermodelle, etwa gewichtete lineare oder quadratische Ansätze, teilweise kompensieren, ideal ist jedoch eine lineare Kalibrierung. Wird für alle Analyten ein lineares Modell verwendet, kommt der Qualität der Peakintegration eine besondere Bedeutung zu. Abschließend ist zu beachten, dass der niedrigste Punkt eines linearen Kalibrierbereichs nicht zwangsläufig der tatsächlichen Nachweisgrenze entspricht.
Tabelle II: Kalibrierbereich der Ergebnisse und Anzahl der Kalibrierpunkte fûr jede halbflüchtige Verbindung.
| Name | Min (ppb) | Max (ppb) | Anzahl der Punkte |
|---|---|---|---|
| N-Nitrosodimethylamine | 2 | 1000 | 8 |
| Pyridine | 50 | 2000 | 6 |
| 2-Fluorophenol | 0.5 | 20 | 6 |
| Phenol-d6 | 2 | 200 | 6 |
| Phenol | 2 | 200 | 5 |
| Aniline | 2 | 200 | 6 |
| 2-Chlorophenol | 0.5 | 200 | 7 |
| 2-Methylphenol | 5 | 200 | 6 |
| 3- and 4-Methylphenol | 2 | 1000 | 8 |
| Nitrobenzene-d5 | 5 | 1000 | 6 |
| 2-Nitrophenol | 5 | 200 | 5 |
| 2,4-Dimethylphenol | 2 | 200 | 6 |
| Benzoic acid | 100 | 2000 | 5 |
| 2,4-Dichlorophenol | 2 | 2000 | 9 |
| Naphthalene | 1 | 50 | 5 |
| 2,6-Dichlorophenol | 1 | 100 | 5 |
| 4-Chloroaniline | 2 | 200 | 6 |
| 4-Chloro-3-methylphenol | 5 | 2000 | 8 |
| 2-Methylnaphthalene | 1 | 2000 | 10 |
| 1-Methylnaphthalene | 1 | 2000 | 10 |
| 2,4,6-Trichlorophenol | 5 | 1000 | 7 |
| 2,4,5-Trichlorophenol | 10 | 2000 | 8 |
| 2-Fluorobiphenyl | 0.5 | 2000 | 11 |
| o-Nitroaniline | 1 | 100 | 6 |
| Acenaphthylene | 5 | 200 | 5 |
| 3-Nitroaniline | 2 | 100 | 6 |
| Acenaphthene | 5 | 2000 | 7 |
| 2,4-Dinitrophenol | 50 | 2000 | 6 |
| 4-Nitrophenol | 5 | 2000 | 8 |
| 2,3,4,6-Tetrachlorophenol | 10 | 2000 | 7 |
| Fluorene | 5 | 2000 | 9 |
| 4-Nitroaniline | 2 | 200 | 6 |
| 4,6-Dinitro-2-methylphenol | 5 | 100 | 5 |
| Diphenylamine | 5 | 200 | 5 |
| 2,4,6-Tribromophenol | 20 | 2000 | 7 |
| Pentachlorophenol | 10 | 1000 | 6 |
| Phenanthrene | 1 | 200 | 7 |
| Dinoseb | 10 | 200 | 5 |
| Anthracene | 5 | 200 | 6 |
| Fluoranthene | 10 | 200 | 5 |
| Benzidine | 50 | 2000 | 5 |
| Pyrene | 5 | 100 | 5 |
| p-Terphenyl-d14 | 1 | 200 | 7 |
| 3,3′-Dichlorobenzidine | 20 | 200 | 5 |
| Benz[a]anthracene | 20 | 500 | 5 |
| Chrysene | 10 | 1000 | 5 |
| Benzo[b]fluoranthene | 20 | 1000 | 5 |
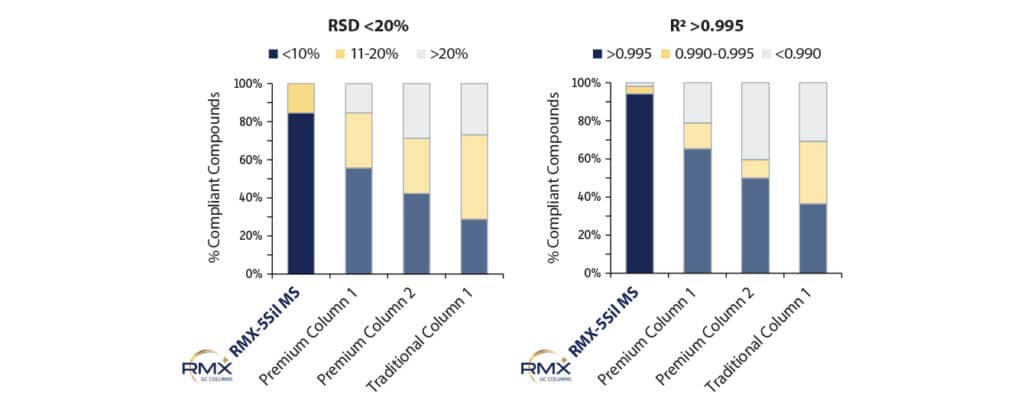
Nachdem die linearen Kalibrierkurven zunächst auf der RMX-5Sil MS-Säule erstellt worden waren, wurden für alle weiteren Säulen Kalibrierungen unter identischen Bedingungen durchgeführt. Kalibrierbereich und Integrationseinstellungen wurden dabei unverändert übernommen. Die Qualität der linearen Anpassung wurde anhand des Bestimmtheitskoeffizienten R² (ungewichtet) sowie der relativen Standardabweichung (%RSD) bewertet. Die Ergebnisse zeigen, dass mit der RMX-5Sil MS-Säule für eine größere Anzahl von Verbindungen Kalibrierungen erzielt wurden, die die methodischen Anforderungen erfüllten (Abbildung 4). Die im Vergleich besseren R²- und %RSD-Werte weisen auf eine insgesamt stabilere Linearität der Kalibrierkurven hin. Dies wirkt sich unmittelbar positiv auf die quantitative Präzision und die Richtigkeit der Ergebnisse aus.
Wiederfindung
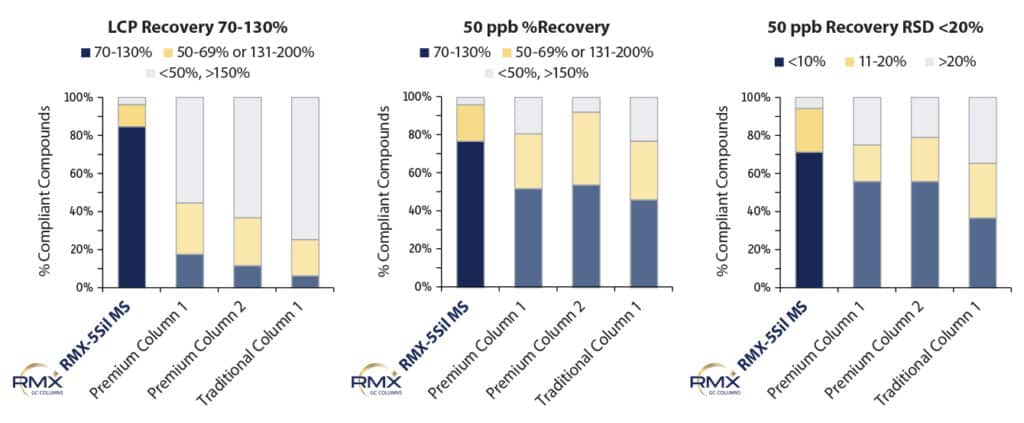
Die Wiederfindung wurde sowohl am niedrigsten Kalibrierpunkt als auch bei einer mittleren Konzentration von 50 ppb bestimmt, um den Einfluss der Säulenauswahl zu bewerten. Die Reproduzierbarkeit der Wiederfindung wurde bei 50 ppb untersucht, da dieser Konzentrationsbereich die Säulenperformance besser widerspiegelt als der niedrigste Kalibrierpunkt (LCP). Am LCP wird die Peakform stärker vom instrumentellen Grundrauschen beeinflusst. Wie Abbildung 5 zeigt, lagen die Wiederfindungsraten am LCP auf der RMX-5Sil MS-Säule deutlich über denen der anderen getesteten Säulen. Dies weist auf eine effektivere Deaktivierung hin, die sowohl die Peakantwort als auch die Integration im Spurenbereich verbessert. Bei der mittleren Konzentration von 50 ppb zeigten alle Säulen vergleichbare Wiederfindungsraten, die Ergebnisse auf der RMX-5Sil MS-Säule waren jedoch deutlich konsistenter. Die Reproduzierbarkeit der Wiederfindung hängt eng mit der Peakform und dem verwendeten Integrationsalgorithmus zusammen. Bereits geringe Unterschiede in der Peakform können die Integration beeinflussen und zu Streuungen zwischen einzelnen Injektionen führen. Die hohe Konsistenz der mit der RMX-5Sil MS-Säule erzielten Ergebnisse zeigt, dass die TriMax-Deaktivierung die Oberflächenaktivität wirksam reduziert und damit eine wichtige Ursache für Variabilität zwischen Injektionen minimiert.
Schlussfolgerung
Säulen des Typs 5 und 5Sil bieten grundsätzlich eine geeignete Selektivität für die Analyse halbflüchtiger Verbindungen und sind weltweit etabliert. Herkömmliche Deaktivierungen reichen jedoch oft nicht aus, um alle aktiven Stellen zuverlässig zu blockieren. Das erschwert insbesondere die Analyse aktiver Verbindungen im Spurenbereich. Die Folge sind Einschränkungen in der Datenqualität und ein höherer analytischer Aufwand – etwa dann, wenn unterschiedliche Säulen für verschiedene Analytengruppen eingesetzt werden müssen oder Qualitätskriterien nicht zuverlässig erreicht werden. Die in dieser Studie vorgestellten Ergebnisse zeigen, dass die bei RMX-5Sil MS-Säulen eingesetzte TriMax-Deaktivierung eine deutlich höhere Inertheit der Säulenoberfläche erreicht. Dadurch wird eine konsistent hohe Performance für alle getesteten Verbindungsklassen erreicht. Mit RMX-5Sil MS-Säulen konnten die definierten Datenqualitätsziele für deutlich mehr halbflüchtige Verbindungen erfüllt werden als mit anderen analytischen Säulen. Diese verbesserte Leistung für saure, basische und neutrale Analyten eröffnet Laboren neue Spielräume: geringerer Lösemittelverbrauch, stabilere Methoden und eine stärkere Konsolidierung analytischer Verfahren – bei gleichzeitigem Ersatz herkömmlicher 5-Säulen.
Literaturhinweise
- E. Pack, C. English, R. Dhandapani, and C. Myers, Increase lab efficiency with an expanded trace-level semivolatiles method, Featured application note, EVFA5253, Restek Corporation, 2025. https://discover.restek.com/articles/evfa5253/increase-lab-efficiency-with-an-expanded-trace-level-semivolatiles-method